Dosage des nitrosamines dans la fumée latérale de tabac
Santé Canada
T-209, 31 décembre 1999
Table des matières
- Portée
- Méthodes applicables
- Définitions
- Résumé de la méthode
- Appareillage et équipement
- Réactifs et matériel
- Préparation de la verrerie
- Préparation des solutions
- Préparation des étalons
- Échantillonnage
- Préparation des produits du tabac
- Préparation de la machine à fumer
- Production des échantillons
- Analyse des échantillons
- Contrôle de la qualité
- Modifications pour fumage intense
- Références
- Annexes
1 Portée
- Les nitrosamines volatiles (NAV) sont produites lors du traitement du tabac ou du fumage de produits du tabac. Parmi les méthodes utilisées pour le traitement du tabac, on compte le séchage à l'air, le séchage au soleil, le séchage à l'air chaud, le séchage au feu, le vieillissement et la fermentation.
- La fumée principale est obtenue par fumage mécanique de cigarettes dans des conditions normalisées, conformément à la méthode T-115. La fumée latérale est, essentiellement, toute fumée autre que la fumée principale de tabac qui est émise par une cigarette.
- Cette méthode est adaptée au dosage de quatre N-nitrosamines spécifiques du tabac (NAST) présentes dans la fumée latérale : N-nitrosonornicotine (NNN), 4-(Nnitrosométhylamino)- 1-(3-pyridyl)-1-butanone (NNK), N-nitrosoanatabine (NAT) et N-nitrosoanabasine (NAB).
2 Méthodes applicables
- American Society for Testing and Materials (ASTM) : Méthode D 1193-77, Standard Specifications for Reagent Water, Version 1977.
- Méthode d'analyse T-115 de Santé Canada : Dosage du « goudron », de la nicotine et du monoxyde de carbone (CO) dans la fumée principale de tabac, 1999-12-31.
3 Définitions
- Pour une définition des termes utilisés dans le présent document, se reporter à la méthode T-115.
4 Résumé de la méthode
- Quatre cigarettes* sont fumées l'une après l'autre sous une chambre en Y de la British American Tobacco (BAT), dont les parois ont été enduites d'acide ascorbique et dans laquelle circule un courant d'air à un débit de 2 L/minute pour entraîner la fumée latérale.
- La fumée latérale est acheminée dans une solution tampon aqueuse contenant de l'acide ascorbique, ce qui empêche la formation des NAST en piégeant les oxydes d'azote. La fumée latérale est ensuite piégée sur un disque (tampon) filtrant prétraité (avec de l'acide ascorbique) en fibre de verre, de 44 mm.
- Les NAST sont concentrées en combinant les produits d'extraction au dichlorométhane de la solution tampon aqueuse et du tampon-filtre Cambridge, puis en procédant à une séparation par chromatographie sur colonne d'alumine basique.
- La fraction contenant les NAST est éluée, puis dosée par chromatographie en phase gazeuse couplée à un analyseur d'énergie thermique (CG-AET). La Nnitrosoguvocoline (NG) est utilisée comme étalon interne.
*Pour l'analyse d'autres produits du tabac, choisir un nombre de produits tel que les filtres pourront piéger toute la matière solide.
Nota : L'analyse et l'évaluation de certains produits à l'aide de cette méthode peuvent nécessiter l'utilisation de substances ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode normalisée, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte des règlements en vigueur.
Ces quatre NAST sont des substances cancérogènes chez plusieurs espèces d'animaux de laboratoire. Elles doivent être manipulées avec un soin extrême. Les rejets du détecteur AET doivent être évacués de façon appropriés afin de réduire le plus possible les risques d'exposition à un excès d'ozone (03).
5 Appareillage et équipement
- Équipement nécessaire au fumage mécanique des produits du tabac, tel que défini dans la méthode T-115.
- Équipement nécessaire au conditionnement, tel que défini dans la méthode T-115.
- Équipement nécessaire au marquage de la longueur des mégots, tel que défini dans la méthode T-115.
- Ballon de 250 mL avec col en verre rodé.
- Fioles jaugées de 2, 10, 50, 100 et 200 mL.
- Bécher de 100 mL.
- Agitateur oscillant Burrell
- Colonne de CL, munie d'un fritté et d'un robinet, 300 mm X 22 mm d.i. X 25 mm d.e. (Supelco 64754), ou l'équivalent.
- Laine de verre silanisée.
- Entonnoirs en verre à tige courte.
- Ampoules à décantation de 250 mL.
- Pipettes Pasteur en verre.
- Turbo-évaporateur Zymark TurboVap II, muni de tubes de 200 mL avec extrémité graduée de 1 mL, ou l'équivalent.
- Analyseur d'énergie thermique (Thermo-Electron Corp.) couplé au CG, ou l'équivalent.
- Pompes GAST ou l'équivalent.
- Débitmètres ACE ou l'équivalent.
- Chambres en Y BAT.
- Impacteurs de 70 mL à joints en verre rodé et manchons en téflon.
- Chromatographe en phase gazeuse, avec injecteur à température programmable, contrôle électronique du débit et logiciels de traitement des données.
- Colonne capillaire en silice fondue DB-1 pour CG, 30 m X 0,32 mm X 3,0 μm.
- Éclairage autre qu'éclairage ultraviolet (UV).
6 Réactifs et matériel
Nota : Tous les réactifs doivent être, au minimum, des réactifs de qualité analytique.
- Dichlorométhane (distillé en verre).
- Acétone (distillée en verre).
- Sulfate de sodium - anhydre.
- Alumine basique.
- Acide citrique (anhydre).
- Acide L-ascorbique.
- Phosphate monosodique.
- Méthanol - DIG.
- Eau de type I.
- Feuille d'aluminium.
- Boîte de Pétri.
7 Préparation de la verrerie
- Le lavage et le séchage doivent être effectués de manière à ce que la verrerie ne soit pas une source de contamination.
8 Préparation des solutions
- Solution 1/1 d'acétone et de dichlorométhane
- Mélanger de l'acétone et du dichlorométhane dans un rapport volumique de 1/1.
- Tampon de citrate-phosphate contenant de l'acide L-ascorbique
- Préparer 1 L de solution dans de l'eau de type I. Cette solution contient :
- 55 mM d'acide citrique;
- 90 mM de phosphate monosodique;
- 20 mM d'acide L-ascorbique.
Nota : Le pH de la solution doit se situer entre 4,3 et 4,5. Sinon, il faut préparer une nouvelle solution.
- Préparer 1 L de solution dans de l'eau de type I. Cette solution contient :
- Solution aqueuse d'acide L-ascorbique, pour le prétraitement des tampons de piégeage de la fumée latérale
- Peser 33,33 g d'acide L-ascorbique dans une fiole jaugée de 200 mL.
- Compléter avec de l'eau de type I.
Nota : Si la solution a jauni, préparer une nouvelle solution.
9 Préparation des étalons
- Étalon interne de N-nitrosoguvacoline (NG)
- Préparer une solution de 5000 ng/mL dans du dichlorométhane.
- Solution étalon mixte de NAST
- Préparer une solution étalon mixte de NNN, de NAT, de NAB et de NNK dans du dichlorométhane, présentant les concentrations suivantes :
- 3000 ng/mL de NNK;
- 1500 ng/mL de NNN et de NAT;
- 500 ng/mL de NAB.
Nota : Les solutions concentrées sont stables pendant environ six mois, si elles sont conservées à - 20 °C de manière à prévenir toute perte de solvant par évaporation.
- La plage de concentrations doit varier d'environ 20 ng/mL (pour la NAB) à 2000 ng/mL (pour la NNK) et les solutions doivent contenir 500 ng/mL de NG comme étalon interne.
- Des courbes d'étalonnage représentatives sont données dans l'annexe V.
Nota : Les solutions d'étalonnage individuelles sont stables pendant deux mois si elles sont conservées de façon appropriée au congélateur.
- Préparer une solution étalon mixte de NNN, de NAT, de NAB et de NNK dans du dichlorométhane, présentant les concentrations suivantes :
10 Échantillonnage
- L'échantillonnage des produits du tabac à analyser doit être effectué conformément à la méthode T-115.
11 Préparation des produits du tabac
- Le conditionnement du produit doit être effectué conformément à la méthode T-115.
- La longueur de mégot des cigarettes, des équivalents-cigarettes, des bidis, des kreteks et des cigares doit être indiquée conformément à la méthode T-115.
- La préparation des cigarettes à fumer dans des conditions intenses doit être effectuée conformément à la méthode T-115.
12 Préparation de la machine à fumer
- Conditions ambiantes
- Les conditions ambiantes de fumage doivent être conformes à celles de la méthode T-115.
- Les salles dans lesquelles les échantillons sont obtenus et analysés doivent être munies d'un système d'éclairage autre qu'un éclairage UV.
- Conditions relatives à la machine à fumer
- Les conditions relatives à la machine à fumer doivent être conformes à celles de la méthode T-115, avec les modifications suivantes :
- Prétraitement du tampon de piégeage de la fumée latérale.
- Saturer le tampon de piégeage de la fumée latérale avec la solution aqueuse d'acide L-ascorbique, en plaçant tampon dans une boîte de Pétri avec la solution pendant 15 secondes, en le retournant, puis en le laissant encore15 secondes dans la boîte.
- Placer les tampons sur un support dans la CAC et les conditionner pendant 24 - 48 heures, pour qu'ils puissent sécher et atteindre l'équilibre.
Nota : Au cours des 48 heures, les tampons jauniront légèrement et prendront un aspect cassant.
- Prétraitement de la chambre en Y BAT.
- Préparer une suspension d'acide L-ascorbique dans du méthanol, dans un bécher de 100 mL.
- Verser la suspension sur les parois de la chambre en Y, en la faisant s'écouler de la partie évasée jusqu'à l'autre extrémité, afin d'obtenir un revêtement uniforme sur toute la surface intérieure de la chambre.
Note : L'épaisseur du revêtement doit être telle qu'il ne soit pas possible de voir à travers les parois de la chambre.
- Production et piégeage de la fumée latérale
- Préparer deux impacteurs de 70 mL en ajoutant dans chacun 25 mL du tampon de citrate-phosphate contenant de l'acide L-ascorbique.
- Connecter les impacteurs en série à la sortie de la chambre en Y BAT et placer un tampon-filtre Cambridge prétraité de 44 mm après le deuxième impacteur, comme dans l'illustration.
- Placer un débitmètre entre le tampon-filtre Cambridge et une source constante de vide. Régler le débit à 2 L/minute.
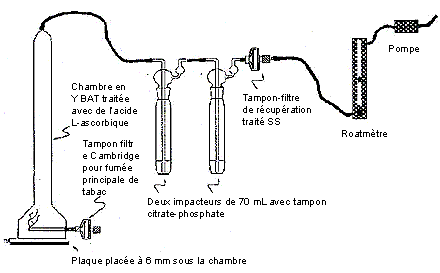
Diagramme de l'appareil pour l'analyse de la fumée latérale
La figure suivante présente un dispositif pour fumée latérale. La chambre en Y de BAT contient un tampon filtrant en verre pour fumée principale qui est connecté au canal situé à la base de la machine à fumer. À l’intérieur, la cheminée en Y de BAT est traitée à l’acide L-ascorbique. Le porte-tampon pour fumée latérale de la cheminée en Y de BAT est connecté par le tube de Tygon à deux impacteurs de 70 mL disposés en série, chacun contenant la solution tampon de citrate-phosphate. Le deuxième impacteur est ensuite connecté, dans le sens de la sortie, à un dispositif traitant le porte-filtre de fumée latérale de tabac aux fins de collecte. Le circuit est aussi connecté plus loin à un rotamètre puis à une pompe contrôlant le débit d’évacuation.
13 Production des échantillons
- Placer une cigarette dans le porte-cigarette relié à la machine à fumer de type piston.
- Allumer la cigarette et abaisser la chambre en Y au-dessus de la cigarette, en plaçant une plaque métallique à 6 mm sous la chambre. Fumer la cigarette de la manière indiquée dans la méthode T-115.
- Fumer quatre cigarettes en procédant de cette manière et piéger la fumée latérale pour obtenir un échantillon.
14 Analyse des échantillons
- Extraction et concentration des NAST
- Immédiatement après le fumage, placer le tampon-filtre pour fumée latérale dans un ballon de 250 mL enveloppé dans une feuille d'aluminium.
- Ajouter 100 µL d'étalon interne dans le ballon.
- Combiner les solutions tampons provenant des deux impacteurs dans une ampoule de décantation de 250 mL.
- Laver (rincer) chaque impacteur avec 25 mL (50 mL au total) de dichlorométhane, puis verser les liquides de lavage (rinçage) dans l'ampoule de décantation.
- Agiter l'ampoule de décantation pour extraire les NAST.
- Soutirer la couche de dichlorométhane dans le ballon contenant le tampon-filtre pour fumée latérale.
- Répéter l'extraction (articles 12.1.5 à 12.1.6) avec deux volumes supplémentaires de 50 mL de dichlorométhane (volume total d'extraction de 150 mL).
- Extraire le tampon-filtre en plaçant le ballon sur un agitateur oscillant Burrell, puis agiter pendant 30 minutes jusqu'à ce que le tampon soit complétement désagrégé.
- Placer un tampon de laine de verre silanisée dans le tube d'un entonnoir en verre.
- Ajouter environ 2 g de sulfate de sodium anhydre (1 cm d'épaisseur dans l'entonnoir).
- Verser l'extrait contenu dans le ballon de 250 mL dans l'entonnoir et récupérer directement le filtrat dans un tube de 200 mL pour turboévaporateur.
- Rincer le ballon avec deux portions de 20 mL de dichlorométhane, puis verser les liquides de rinçage dans l'entonnoir pour entraîner tous les NAST extraits dans le tube pour turbo-évaporateur.
- Après passage de toute la solution dans l'entonnoir (aucune goutte ne s'échappe de la tige de l'entonnoir), mettre l'échantillon sur le turbo-évaporateur TurboVap II réglé à 38 °C et à 10 lb/po2 d'azote.
- Réduire le volume des échantillons jusqu'à 5 mL environ.
- Purification par chromatographie sur colonne
- Préparer une colonne d'alumine basique en ajoutant 50 mL de dichlorométhane (DCM) dans une colonne pour chromatographie liquide, en verre, vide et sèche.
- Ajouter 10 g (+/- 0,2) d'alumine basique, séchée à l'étuve (110 °C), au liquide dans la colonne. Agiter la suspension d'alumine avec une tige en verre pour éliminer toutes les poches d'air.
- Laisser le liquide s'écouler de la colonne en fermant le robinet quand le niveau du liquide atteint le niveau de l'alumine.
- Laver l'alumine en ajoutant 50 mL de dichlorométhane dans la colonne. Laisser le liquide s'écouler de la colonne en fermant le robinet quand le niveau du liquide atteint le niveau de l'alumine.
- Ajouter sur la colonne l'échantillon de 5 mL contenu dans le tube du turbo-évaporateur, en utilisant une pipette Pasteur en verre pour essayer de ne pas perturber le remplissage d'alumine.
- Laisser le liquide s'écouler de la colonne en fermant le robinet quand le niveau du liquide atteint le niveau de l'alumine.
- Rincer le tube du turbo-évaporateur avec 10 mL de dichlorométhane, en rinçant la partie inférieure (25 %) du tube plusieurs fois à l'aide d'une pipette Pasteur.
- Ajouter sur la colonne les 10 mL de liquides de rinçage du tube du turbo-évaporateur, en essayant de ne pas perturber le remplissage d'alumine.
- Laisser le liquide s'écouler de la colonne, puis jeter ce liquide. Fermer le robinet quand le niveau du liquide atteint le niveau de l'alumine.
- Rincer le tube du turbo-évaporateur et la colonne d'alumine avec une autre portion de 40 mL de dichlorométhane, en essayant de ne pas perturber le remplissage d'alumine. Laissant le liquide s'écouler de la colonne, puis le jeter.
- Placer un tube propre de 200 mL pour turbo-évaporateur sous la colonne de chromatographie liquide pour récupérer l'échantillon.
- Éluer les NAST de la colonne d'alumine en ajoutant 50 mL du mélange 1/1 d'acétone et de dichlorométhane, en essayant de ne pas perturber le remplissage.
- Récupérer le liquide dans le tube pour turbo-évaporateur, en fermant le robinet quand le niveau du liquide atteint le niveau de l'alumine.
- Répéter encore quatre fois les étapes 14.2.12 et 14.2.13 en récupérant l'éluat dans le même tube (au total 250 mL récupérés).
Nota : Pour ce faire, évaporer une portion de l'éluat avant de récupérer les derniers 50 mL dans le même tube.
- Reconcentration de l'échantillon
- Placer les échantillons dans le turbo-évaporateur TurboVap II réglé à 38 °C et à 9 lb/po2 d'azote.
- Après réduction du volume des échantillons à environ 150 mL, augmenter la pression à 10 lb/po2.
- Réduire le volume des échantillons à 0,8 mL ou jusqu'à temps que le capteur arrête l'évaporateur (cette opération nécessite environ 45 minutes).
- Ajouter du dichlorométhane jusqu'à la graduation de 1,0 mL du tube.
- Rincer la partie inférieure (25 %) du tube avec l'extrait final, pour redissoudre tout résidu qui aurait pu sécher sur les parois.
- Pour l'analyse par CG, transférer l'échantillon dans un flacon ambre pour échantillonneur automatique, muni d'un septum recouvert de téflon.
- Analyse par CG/AET
- Paramètres du CG/AET
- Débit du gaz vecteur (He) : 2,8 L/minute, contrôlé électroniquement (vitesse = 60 cm/seconde).
- Température de l'injecteur : programmable de 35 à 220 °C.
- Température du four : programmée de 50 à 170, puis à 212 °C.
- Température de l'interface avec l'AET : 240 oC.
- Température du four de l'AET : 500-525 oC (selon la sensibilité de l'analyseur).
- Durée d'une analyse : 35 minutes.
- Analyse à blanc
- Effectuer périodiquement des analyses à blanc en utilisant de l'air exempt de nitrosamines, pour s'assurer que le milieu d'analyse ne renferme aucune trace de nitrosamines et que ces substances ne sont pas formées pendant l'analyse.
- Étalonnage du CG/AET
- Injecter 1,5 µL d'étalon mixte de NAST et déterminer les aires sous les pics correspondant aux quatre constituants.
- Dosage des NAST
- Injecter 1,5 µL de concentré d'échantillon (14.3.6) et déterminer les aires sous les pics correspondant aux temps de rétention de la NNN, de la NAT, de la NAB et de la NNK.
- Paramètres du CG/AET
- Méthode de calcul
- La concentration, mcig (ng/cigarette), d'une NAST donnée est calculée avec la formule suivante :
mcig = CVs/N.
dans laquelle,
C = concentration de la NAST donnée, déterminée par étalonnage avec un étalon interne pour dopage interne.
Vs = volume final du concentré.
N = nombre de cigarettes/petits cigares/cigares fumés.
- La concentration, mcig (ng/cigarette), d'une NAST donnée est calculée avec la formule suivante :
15 Contrôle de la qualité
- Chromatogramme Typique
- Voir l'annexe.
- Limites de détection de la méthode (LDM) et limites de dosage (LDD)
- Déterminer la limite de détection de la méthode (LDM) en analysant l'étalon le moins concentré, comme s'il s'agissait d'un échantillon, au moins 10 fois sur plusieurs jours. La LDM est égale à trois fois l'écart-type de ces résultats.
- Calculer la LDM (en ng/cigarette) en multipliant la LDM déterminée (exprimée en ng/mL) par le volume final de l'extrait et en divisant ce résultat par le nombre de cigarettes fumées.
- La valeur de la LDM (en ng/cigarette) peut être « améliorée » en modifiant le nombre de cigarettes fumées et les volumes utilisés pour l'extraction et la purification.
- Déterminer la limite de dosage (LDD) en analysant l'étalon le moins concentré, comme s'il s'agissait d'un échantillon, au moins 10 fois sur plusieurs jours. La LDD est égale à 10 fois l'écart-type de ces résultats.
- Calculer la LDD (en ng/cigarette) en multipliant la LDD déterminée (exprimée en ng/mL) par le volume final de l'extrait et en divisant ce résultat par le nombre de cigarettes fumées.
- L'effet sur la LDD de la modification du nombre de cigarettes fumées et des volumes utilisés pour l'extraction et la purification est le même que pour la LDM.
16 Modifications pour fumage intense
- Non-requise.
17 Références
- Adams, J.D., Brunnemann, K.D. et Hoffmann, D., 1983. Chemical studies on tobacco smoke. LXXV. Rapid method for the analysis of tobacco- specific N-nitrosamines by gas- liquid chromatography with a thermal energy analyser. J. Chromatogr., p. 256, 347-351.
- Brunnemann, K.D. et Hoffmann, D., 1981. Assessment of the carcinogenic N-nitrosodiethanolamine in tobacco products and tobacco smoke. Carcinogenesis, p. 2, 1123-1127.
- Hecht, S.S., Adams, J.D. et Hoffmann, D., 1983. Tobacco- specific nitrosamines in tobacco and tobacco smoke. In: Preussmann, R., O'Neill, I.K., Eisenbrand, G., Spiegelhalder, B. et Bartsch, H., éditeurs, Environmental Carcinogens- Selected Methods of Analysis, vol. 6, N-Nitroso Compounds (IARC Scientific Publications no 5), Lyon, Agence internationale de recherche sur le cancer, p. 93-101.
- Hoffmann, D., Adams, J.D., Brunnemann, K. D. et Hecht, S. S., 1979. Assessment of tobacco- specific N-nitrosamines in tobacco products. Cancer Res., p. 39, 2505-2509.
- Risner, Charles H. et Wendelboe, Fred N., 1994. Quantification of Tobacco Specific Nitrosamines in Tobacco. Tob. Sci., 38 : p. 1-6.
18 Annexes
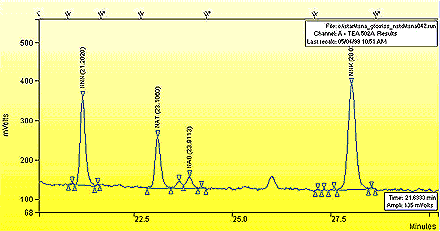
Annexe 2 : Chromatogramme typique
Chromatogramme typique de l'extrait de fumée latérale provenant de la 1R4F.
Les figures présentent des chromatogrammes typiques de l’extrait de fumée latérale de tabac provenant d’une cigarette 1R4F. Les millivolts du dispositif sont présentés en fonction du temps écoulé en minutes.
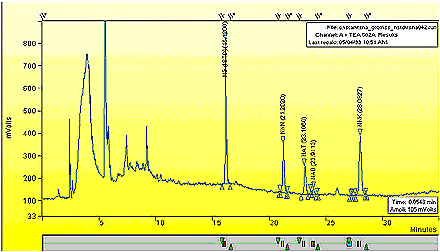
Un agrandissement du chromatogramme précédent est donné à la page suivante.