Dosage des alcaloïdes dans le tabac entier
Santé Canada
T-301 31 décembre 1999
Table des matières
- Portée des applications
- Méthodes applicables
- Définitions
- Résumé de la méthode
- Appareillage et équipement
- Réactifs et matériel
- Préparation de la verrerie
- Préparation des solutions
- Préparation des étalons
- Échantillonnage
- Contrôle de la qualité
- Références
- Annexes
1 Portée des applications
- Cette méthode sert à doser la teneur en nicotine, en nornicotine, en anabasine, en myosmine et en anatabine (alcaloïdes) du tabac entier. Elle est conçue pour doser directement la nicotine au moyen d'un étalon, qui sert également à doser les autres alcaloïdes en faisant l'hypothèse de facteurs de réponse semblables.
- La nornicotine, l'anabasine et la myosmine peuvent aussi être dosées (au besoin) à l'aide de courbe d'étalonnage établies à partir d'étalons disponibles commercialement. L'anatabine doit être dosée en utilisant le facteur de réponse calculé à partir d'étalons d'anabasine.
- La teneur totale en alcaloïdes est calculée comme étant la somme des teneurs en nicotine, en nornicotine, en anabasine, en myosmine et en anatabine.
2 Méthodes applicables
- American Society for Testing and Materials (ASTM) : Méthode D1193-77 Standard Specification for Reagent Water, Version 1977.
- Méthode d'essai de Santé Canada T-115 - Dosage du goudron, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 1999-12-31.
- Méthode d'essai de Santé Canada T-402 - Préparation des cigarettes, du tabac à cigarettes, des cigares, des kreteks, des bidis, du tabac en feuille, du tabac à pipe et du tabac sans fumée aux fins d'essais, 1999-12-31.
3 Définitions
- Pour la définition des termes utilisés dans le présent document, consulter la publication T-115.
4 Résumé de la méthode
- L'analyse est réalisée par chromatographie en phase gazeuse (CPG), à l'aide d'une colonne capillaire en silice fondue et d'un détecteur thermoïonique spécifique (DTS). L'extraction de vingt-cinq milligrammes de tabac lyophilisé et moulu est réalisée avec 1,0 mL d'une solution méthanolique de KOH (contenant du 2,4-dipyridyle comme étalon interne), dans un bain ultrasonique pendant trois heures. Le mélange est ensuite centrifugé à faible vitesse pour séparer le tabac solide de la solution. Le surnageant est transvasé dans un flacon pour échantillonneur automatique et se trouve ainsi prêt à être analysé par CPG.
- Les alcaloïdes sont chromatographiés sur une colonne capillaire en silice fondue CAM, qui contient une phase stationnaire de polyéthylèneglycol (PEG), spécifiquement désactivée en milieu basique pour l'analyse des amines volatiles. Le dosage est réalisé par étalonnage interne, en comparant la réponse du DTS pour les analytes de l'échantillon à un étalonnage réalisé en cinq points avec de la nicotine.
Nota : L'analyse et l'évaluation de certains produits à l'aide de cette méthode peuvent nécessiter l'utilisation de substances ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode normalisée, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte des règlements en vigueur.
5 Appareillage et équipement
- Lyophilisateur.
- Tubes à culture jetables en verre borosilicaté.
- Fioles jaugées de 10 mL, de 1000 mL et de 2000 mL.
- Pipettes pasteur en verre.
- Micropipettes ou seringue étanche aux gaz pour la préparation des étalons dilués (volumes en fonction de la concentration des étalons mères).
- Pipettes distributrices de 1 - 5 mL.
- Parafilm (pour boucher les tubes d'extraction).
- Flacon à scintillation de 20 mL, avec bouchon revêtu d'aluminium.
- Broyeur de laboratoire avec tamis no 40.
- Coton-tiges, pour nettoyer le broyeur.
- Chromatographe en phase gazeuse Varian 3400 / 3600 ou l'équivalent.
- Échantillonneur automatique Varian 8100 / 8200CX ou l'équivalent.
- Flacons pour échantillonneur automatique, avec bouchon et septum revêtu de téflon.
- Colonne capillaire en silice fondue CAM - 30 m × 0,25 mm × 0,25 µm.
- Bain à ultrasons.
- Balance analytique permettant de mesurer à la quatrième décimale.
- Centrifugeuse.
- Mélangeur rotatif.
6 Réactifs et matériel
Nota : Tous les réactifs doivent être, au minimum, des réactifs de qualité analytique.
- Méthanol distillé sous verre.
- Hydroxyde de potassium.
- Eau de type I (respectant les spécifications de la norme D 1193 de l'ASTM).
- 2,4-dipyridyle - utilisé comme étalon interne (ISTD).
- (-)-Nicotine*.
- Dans le cas où le dosage des alcaloïdes mineurs est spécifiquement requis :
(+/-)-anabasine* - néonicotine*.
(+/-)-nornicotine - 2-[3-pyridyl]-pyrrolidine*.
myosmine - 3-[1-pyrrolin-2-yl]pyrroline*.
*Nota : La pureté de tous les composés doit être connue et le plus proche possible de 100 %.
7 Préparation de la verrerie
- La verrerie doit être lavée et séchée de façon à s'assurer qu'elle ne causera aucune contamination.
8 Préparation des solutions
- Solution pour extraction - (0,25 mg/mL de 2,4-dipyridyle dans du KOH méthanolique)
- Peser 5,6 g (+/- 0,05 g) d'hydroxyde de potassium dans une fiole jaugée de 2000 mL et remplir au trait avec du méthanol.
Nota : Une sonication est nécessaire pour dissoudre les pastilles. - Apposer une étiquette sur la fiole indiquant « KOH 0,05 N dans MeOH », ainsi que la date de préparation.
- Peser exactement (sur une balance précise à la quatrième décimale) 0,25 g (+/- 0,005 g) de 2,4-dipyridyle dans une fiole jaugée de 1000 mL, puis remplir au trait avec la solution méthanolique de KOH 0,05 N.
- Bien mélanger et transvaser le contenu dans une bouteille distributrice de 1250 mL. Apposer une étiquette indiquant « Solution pour extraction des alcaloïdes », ainsi que la date de préparation.
Nota: Lorsqu'une nouvelle solution pour extraction est préparée, il faut préparer une nouvelle série d'étalons dilués pour s'assurer d'avoir la quantité correspondante d'étalon interne dans les échantillons et les étalons.
- Peser 5,6 g (+/- 0,05 g) d'hydroxyde de potassium dans une fiole jaugée de 2000 mL et remplir au trait avec du méthanol.
9 Préparation des étalons
- Étalon mère primaire de nicotine ( concentration approximative : 5 mg/mL)
- Peser exactement 0,05 g (+/- 0,005 g) de nicotine dans une fiole jaugée de 10 mL et remplir au trait avec de la solution d'extraction.
Nota 1 : La nicotine est très hygroscopique et sa pesée doit être faite avec soin et rapidement pour prévenir toute absorption d'humidité.
Nota 2 : Les solutions étalons mères primaires des alcaloïdes mineurs (réalisées au besoin) sont faites de la même manière. Bien que leurs teneurs soient considérablement moindres que celle de la nicotine, il est recommandé de ne pas peser moins de produit étalon, mais plutôt de faire une solution mère secondaire pour la préparation des étalons dilués.
- Peser exactement 0,05 g (+/- 0,005 g) de nicotine dans une fiole jaugée de 10 mL et remplir au trait avec de la solution d'extraction.
- Étalons dilués
- Tous les étalons sont préparés dans des fioles jaugées, en utilisant les facteurs de dilution mentionnés au tableau suivant.
Le tableau suivant présente les étalons de travail (1-5), y compris le volume des étalons primaires, le volume final, la teneur en nicotine et le rapport nicotine-étalon interne.
Étalon de
nicotineVolume
d'étalon mère
primaire (μL)Volume
Final
(mL)Nicotine
[μg/mL]Rapport Nicotine/
Étalon interneÉtalon 1 2000 10 1000 4 Étalon 2 1000 10 500 2 Étalon 3 500 10 250 1 Étalon 4 250 10 125 0,5 Étalon 5 100 10 50 0,2 - Les fioles jaugées sont remplies au trait de la solution pour extraction contenant l'étalon interne.
Nota 1 : Les concentrations d'analyse peuvent varier en fonction de la concentration de l'étalon mère primaire et doivent être calculées afin d'obtenir un étalonnage exact.
Nota 2 : Pour obtenir une gamme d'étalonnage plus étroite pour le dosage des alcaloïdes mineurs, un étalon de concentration 10 fois plus faible que celle de l'étalon de nicotine le moins concentré peut être préparé. Un autre facteur de réponse pour les alcaloïdes mineurs (ou une autre courbe d'étalonnage) peut être calculé avec les résultas obtenus avec les trois étalons les moins concentrés.
- Tous les étalons sont préparés dans des fioles jaugées, en utilisant les facteurs de dilution mentionnés au tableau suivant.
10 Échantillonnage
- Détermination du degré d'humidité
- Peser exactement un flacon à scintillation sec de 20 mL, correctement étiqueté, avec son bouchon revêtu d'aluminium.
- Transvaser le tabac trois cigarettes (ou 2 g) dans ce flacon.
- Peser exactement ce flacon bouché, avec le tabac qu'il contient.
- Placer les échantillons au congélateur au moins une heure avant de les mettre dans le lyophilisateur.
- Mettre les échantillons dans le lyophilisateur, avec le bouchon du flacon desserré afin de laisser l'eau du tabac s'évaporer.
- Après un minimum de 48 heures, retirer les flacons du lyophilisateur et resserrer les bouchons immédiatement pour empêcher toute réabsorption d'eau atmosphérique.
- Peser exactement le flacon après la lyophilisation et calculer le degré d'humidité (%) du tabac.
- Broyage des échantillons
- Broyer le tabac avec le broyeur de laboratoire et un tamis no 40 (40 mailles au pouce carré).
- Après le broyage, récupérer les particules restantes de tabac avec un coton-tige, puis passer l'aspirateur dans le broyeur pour en éliminer toutes les poussières de tabac.
- Démonter le broyeur et le nettoyer avec du méthanol.
- Le remonter et passer de nouveau l'aspirateur pour éliminer tout résidu de méthanol.
- Répéter ce nettoyage après chaque broyage d'un échantillon.
- Extraction des échantillons
- Peser exactement 25 mg (+/- 5 mg) de tabac moulu dans un tube à culture jetable en verre borosilicaté, de 10 mm × 125 mm.
- Ajouter 1 mL de solution pour extraction.
- Sceller le tube à culture avec quatre couches de Parafilm® et le placer dans un support métallique adapté au bain à ultrasons.
- Procéder à la sonication des échantillons pendant trois heures.
Nota: La sonication produit de la chaleur, et la température du bain doit être surveillée afin de ne pas dépasser 40 °C. - Retirer les échantillons du bain après une heure pour les mélanger, en agitant le tube pour que tout le tabac se retrouve dans le solvant. Replacer dans le bain à ultrasons.
- Une fois la sonication terminée, centrifuger les tubes pendant cinq minutes à basse vitesse (40 %), pour séparer le tabac du solvant.
- Transvaser le surnageant dans un flacon pour échantillonneur automatique, l'échantillon est prêt pour l'analyse par CG.
- Conditions pour la chromatographie en phase gazeuse.
Injecteur : À division de débit, avec un débit divisé d'environ 35 mL/minute à 110 °C.
Colonne : CAM - 30 m × 0,25 mm × 0,25 µm.
Détecteur : Thermoïonique spécifique (DTS), canal A, un volt à pleine échelle; gamme : 12.
Atténuation : 8; zéro automatique : activé; courant de la bille en céramique : 3,175 ampères (en fonction de son âge et de son utilisation).
Gaz vecteur : He, 15,0 lb/po2, vitesse linéaire d'environ 30 cm/seconde.
Relais : Position initiale, tous (-).
Nota 1 : Régler les débit d'H2 , d'air anhydre et de N2 d'appoint dans le détecteur sont réglés conformément aux spécifications du fabricant.
Programmation de température
Injecteur : 220 °C.
Détecteur : 300 °C.
Température de départ : 110 °C, maintenir une minute.
Gradient : 5 °C/min jusqu'à 225 °C, maintenir deux minutes.
Temps total d'analyse : 26,00 minutes.
Conditions pour l'échantillonneur automatique - volume injecté : 1,0 µL.
Charger les flacons sur l'échantillonneur automatique en commençant par l'étalon de plus forte concentration et en allant vers celui de plus faible concentration et procéder à un nouvel étalonnage avant d'analyser les échantillons.
Nota : Initialement, le premier étalon doit être injecté au moins trois fois pour conditionner la colonne de nouveau. Charger les échantillons dans le carrousel, en plaçant un étalon à toutes les 10 positions pour vérifier l'étalonnage et la qualité de la chromatographie. - Calculs
- Tracer une courbe d'étalonnage interne d'après l'aire sous les pics obtenus avec les solutions étalons. Les facteurs d'étalonnage ainsi déterminés sont utilisés pour calculer la concentration de chaque analyte dans chaque échantillon. En entrant les coefficients multiplicateurs (le volume total de dilution de l'échantillon d'origine, en mL-1) et diviseurs (le poids de l'échantillon d'origine en g, à la quatrième décimale) appropriés, la teneur de chacun des alcaloïdes est calculée automatiquement en µg/g.
Résultats de l'analyse sur la base « tel que reçu » :
Analyte [µg/g] = (AireAnalyte Échan. /AireÉtalon interne) × FR(µg/mL) × (Multiplicateur(mL)/Diviseur(g))
où FR est défini à partir de la courbe d'étalonnage. - Tous les résultats sont exprimés en fonction du poids de « matière sèche ». Ils peuvent l'être en fonction du poids de tabac « tel que reçu », en utilisant le degré d'humidité approprié.
Conversion en fonction du tabac « tel que reçu » :
Analyte [µg/g]« tel que reçu » = Analyte [µg/g]« en matière sèche » × [1-(degré d'humidité (%)/100]
où le degré d'humidité (%) est déterminé par lyophilisation lors de l'Échantillonnage - détermination du degré d'humidité.
- Tracer une courbe d'étalonnage interne d'après l'aire sous les pics obtenus avec les solutions étalons. Les facteurs d'étalonnage ainsi déterminés sont utilisés pour calculer la concentration de chaque analyte dans chaque échantillon. En entrant les coefficients multiplicateurs (le volume total de dilution de l'échantillon d'origine, en mL-1) et diviseurs (le poids de l'échantillon d'origine en g, à la quatrième décimale) appropriés, la teneur de chacun des alcaloïdes est calculée automatiquement en µg/g.
11 Contrôle de la qualité
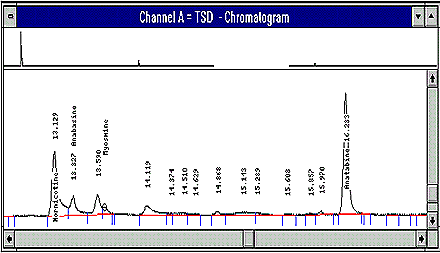
- Chromatogramme typique
Voir les figures 1 et 2 de l'annexe 1. - Taux de récupération et niveaux de contamination
- Chaque série d'analyses doit comprendre un BR par lot de 20 échantillons ou moins. Les BR peuvent renfermer de très faibles teneurs en nicotine, qui restent souvent « non décelées ». En général, la contamination peut être réduite au minimum par un lavage à fond de la verrerie et l'utilisation d'un solvant provenant de bouteilles neuves pour la réalisation des solutions.
Nota : En plus du BR, un blanc de solvant doit être injecté à tous les 10 échantillons, pour évaluer toute contamination. Si la contamination va en augmentant, le tube inséré dans le détecteur et/ou le septum de l'injecteur doivent être remplacés.
- Chaque série d'analyses doit comprendre un BR par lot de 20 échantillons ou moins. Les BR peuvent renfermer de très faibles teneurs en nicotine, qui restent souvent « non décelées ». En général, la contamination peut être réduite au minimum par un lavage à fond de la verrerie et l'utilisation d'un solvant provenant de bouteilles neuves pour la réalisation des solutions.
- Limite de détection de la méthode (LDM)/limite de dosage (LD)
- À cause des très hautes teneurs en nicotine analysées avec cette méthode, il n'est pas nécessaire de calculer la LDM et la LD pour ce composé.
- Les LDM et les LD des alcaloïdes mineurs, qui diffèrent en fonction de la condition du détecteur et de la colonne, doivent être évaluées à chaque fois que l'analyse de ces substances est requise. Un échantillon contenant de faibles teneurs de ces alcaloïdes doit être injecté 10 fois et l'écart-type des mesures de chaque alcaloïde déterminé. La LDM et la LD sont respectivement égales à trois et à 10 fois cet écart-type.
- La LDM peut aussi être déterminée comme étant la quantité de produit donnant un rapport signal/bruit de 3/1 et la LD comme étant celle donnant un rapport signal/bruit de 10/1.
- Stabilité des réactifs et des échantillons
- La colonne CAM contient une phase stationnaire de polyéthylèneglycol, qui a été désactivée par une base pour l'analyse des amines volatiles. Les effets de traînée de pic peuvent, cependant, affecter le dosage des alcaloïdes mineurs, car ils sont présents en quantité plus faibles et produisent donc un rapport signal/bruit plus faible. Ces effets de traînée de pic sont dus à deux sources autres que la réactivité de ces composés :
- Effets de solvant.
- Réactivité dans l'injecteur.
- Le méthanol est, en général, un mauvais choix de solvant pour l'injection dans une colonne de CPG, car il produit une énorme traînée. Cet effet peut être minimalisé par une importante division du débit, le choix d'une grande vitesse d'écoulement, l'utilisation d'une épaisse couche de phase stationnaire et l'insertion d'un tube en verre désactivé dans l'injecteur.
- La réactivité dans l'injecteur est minimalisée par l'insertion de tubes d'injection en verre désactivés. Il faut changer le tube inséré dans l'injecteur entre deux séries d'échantillons (en gros, à tous les 40 échantillons réels), car la solution injectée est relativement sale et crée des sites actifs sur le tube lors d'injections répétées d'échantillons.
- Un étalon de contrôle de la qualité peut être préparé et analysé comme un échantillon. Pour ce faire, on prépare un étalon à partir d'une solution mère indépendante et on l'analyse pour vérifier l'exactitude de l'étalonnage.
- La solution d'extraction peut être utilisée indéfiniment tant qu'elle n'est pas contaminée par de la nicotine.
- Il ne semble pas y avoir de problème de stabilité des échantillons, ni des étalons, s'ils sont conservés au réfrigérateur (4 °C).
- Il est très important de surveiller de près la sonication. Les morceaux de tabac doivent visiblement vibrés et la solution doit avoir une couleur homogène à la fin du traitement.
- La colonne CAM contient une phase stationnaire de polyéthylèneglycol, qui a été désactivée par une base pour l'analyse des amines volatiles. Les effets de traînée de pic peuvent, cependant, affecter le dosage des alcaloïdes mineurs, car ils sont présents en quantité plus faibles et produisent donc un rapport signal/bruit plus faible. Ces effets de traînée de pic sont dus à deux sources autres que la réactivité de ces composés :
12 Références
- R.F. Severson, K.L., McDuffie, R.U. Arrendale, G.R. Gwynn, J.F. Chaplin et A.W. Johnson. J. Chromatog. Rapid Method for the Analysis of Tobacco Nicotine Alkaloids, 1981. p. 211, p. 111-121.
13 Annexes
Annexe : Exemples de chromatographies
Figure 1 : Exemple de chromatogramme d'un échantillon réel de tabac, montrant la concentration de nicotine par rapport à celles des alcaloïdes mineurs. Les temps de rétention sont les suivants :
Nicotine : 8,055 minutes
Nornicotine : 13,129 minutes
Anabasine : 13,307 minutes
Myosmine : 13,622 minutes
Anatabine : 16,233 minutes
2,4-Dipyridyle (étalon interne) : 18,607 minutes.
La figure suivante est un exemple de chromatogramme d’échantillon réel de tabac montrant la teneur en nicotine par rapport à celle des alcaloïdes mineurs.
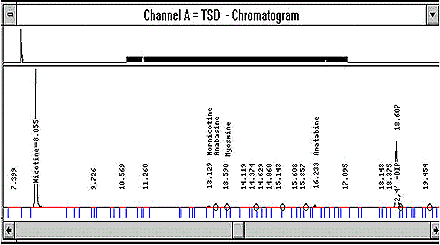
Figure 2 : Agrandissement de la partie de la figure 1 représentant les pics des alcaloïdes mineurs.
Nota : La traînée figurant sur la figure 2 est le maximum acceptable. La résolution de la myosmine et la séparation de l'anabasine de la nornicotine sont les principaux paramètres indiquant la nécessité de couper la colonne (ou de la remplacer).
La figure suivante présente une vue détaillée des alcaloïdes mineurs de la figure 1.