Dosage du benzo[a]pyrène dans la fumée principale de tabac
Santé Canada
T-103 31 décembre 1999
Table des matières
- Portée
- Normes applicables
- Définitions
- Résumé de la méthode
- Appareillage et équipement
- Réactifs et matériel
- Préparation de la verrerie
- Préparation des solutions
- Préparation des étalons
- Échantillonnage
- Préparation des produits du tabac
- Préparation de la machine à fumer
- Production des échantillons
- Analyse des échantillons
- Contrôle de la qualité
- Modifications pour des conditions intenses de fumage
- Références
- Annexes
1 Portée
- La présente méthode s'applique au dosage du benzo[a]pyrène (B[a]P) dans la matière particulaire totale (MPT) du condensat de la fumée principale de tabac par chromatographie liquide haute performance (CLHP) en phase inversée avec détection par fluorescence.
2 Normes applicables
- (ASTM) : Méthode D 1193-77 de l'American Society for Testing and Measurements - Standard Specification for Reagent Water, Version 1977.
- Méthode d'essai T-115 de Santé Canada - Dosage du goudron, de l'eau, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 1999-12-31.
- Méthodes d'échantillonnage et d'essai du tabac : Détermination du benzo[a]pyrène dans la matière particulaire totale de la fumée du tabac. Norme nationale du Canada, Offices des normes générales du Canada CAN/CGSB- 176.2 No 1-96, mars 1996.
3 Définitions
- Pour une définition des termes utilisés dans le présent document, se reporter à la méthode T-115.
4 Résumé de la méthode
- Le produit du tabac est fumé dans les conditions définies dans la méthode T- 115.
- La matière particulaire totale est piégée sur un disque filtrant en fibre de verre (tampon), puis elle est extraite avec suffisamment de cyclohexane pour obtenir un extrait renfermant environ 1 mg de matière particulaire humide par mL.
- Une portion de cette solution est filtrée sur un filtre en PTFE de 0,45 µm en PTFE, puis le filtrat est récupéré dans un flacon en verre de 7 mL. Une portion de 2 mL de l'extrait est passée dans une cartouche contenant 1 g (6 mL) de silice, puis dans une cartouche NH2 plus de 360 mg, montée en série.
- Le B[a]P est élué avec de l'hexane, l'éluat est évaporé jusqu'à siccité sous un courant d'azote constant, puis le résidu est dilué à 1 mL avec de l'acétonitrile.
- L'échantillon est dosé par chromatographie liquide en phase inversée avec détection par fluorescence.
Nota : L'analyse et l'évaluation de certains produits à l'aide de cette méthode d'essai peuvent nécessiter l'utilisation de substances ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode d'essai, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte des règlements en vigueur.
5 Appareillage et équipement
- Équipement nécesaire au conditionnement, tel que défini dans la méthode T- 115.
- Équipement nécessaire au marquage de la longueur des mégots, tel que défini dans la méthode T-115.
- Équipement nécessaire au fumage mécanique des produits du tabac, tel que défini dans la méthode T-115.
- Dispositif d'extraction en phase solide Visi-Prep de Supelco (à 24 cartouches) ou l'équivalent.
- Pipettes en verre de 2 mL.
- Distributeur Brinkman (10-50 mL) ou l'équivalent.
- Micropipettes (10, 50, 500 et 1000 µL).
- Erlenmeyers en verre de 125 et/ou de 250 mL (ou ballons), à rodage conique
- Turbo-évaporateur Zymark ou l'équivalent.
- Fioles jaugées de 2 L.
- Agitateur oscillant.
- Pipettes en verre.
- Mélangeur de laboratoire.
- Colonne pour CLHP Merck RP-18e, de 250 × 4 mm, remplissage de 5 µm.
- Colonne de garde de 5 µm Lichrocart 4-4 Lichrosphere 100 RP-18, ou l'équivalent.
- Balance d'analyse, affichant quatre places décimales.
- Appareil de chromatographie liquide haute performance muni de :
- Détecteur par fluorescence.
- Échantillonneur automatique.
- Pompe ternaire.
- Système de collecte de données.
6 Réactifs et matériel
Nota : Tous les réactifs doivent être, au minimum, des réactifs de qualité analytique.
- Benzo[a]pyrène (B[a]P).
- Cyclohexane.
- Hexane.
- Acétonitrile.
- Méthanol.
- Isopropanol.
- Acétone.
- Sulfate de sodium anhydre.
- Tétrahydrofurane (THF).
- Tubes à culture de 16 × 125 mm (20 mL).
- Disuqes filtrants en fibre de verre (tampon) et porte-filtre (45 mm).
- Seringue jetable de 5 cm3.
- Flacons pour échantillonneur automatique, avec bouchons et septums recouverts de téflon.
- Pipettes Pasteur.
- Catouches de silice de Sep-Pak, de 1 g (capacité de 6 mL).
- Cartouche NH2 Plus de Sep-Pak, de 360 mg.
- Flacons à vis de 7 mL, avec bouchons recouverts d'aluminium.
- Filtres jetables de 0,45 µm, en PTFE, de 13 mm.
- Eau de type I (satisfaisant à la norme D 1193 de l'ASTM).
7 Préparation de la verrerie
- Le lavage et le séchage de la verrerie doivent être effectués de manière à ce que celle-ci ne cause pas de contamination.
8 Préparation des solutions
- Préparer les solutions nécessaires à l'analyse, de la manière définie dans la méthode T-115, selon les techniques de laboratoire appropriées.
9 Préparation des étalons
- Préparation d'une solution de dopage pour les échantillons fortifiés
- Solution mère primaire de B[a]P : Dissoudre 10 mg de B[a]P dans 50 mL de cyclohexane.
- Solution mère secondaire : Pipetter 50 µL de solution mère primaire dans 50 mL de cyclohexane.
- Pour réaliser la matrice fortifiée (MF*), ajouter 10 µL de solution dopante à une deuxième portion de 2 mL de la solution d'extraction de la cigarette témoin, avant la substitution de solvant (14.2.4 à
14.2.8) et la purification sur les cartouches d'extraction en phase solide (MF*). Ajouter encore 10 µL de solution dopante à une deuxième portion de 2 mL de blanc de réactifs (BR*),
avant la substitution de solvant et la purification sur les cartouches d'extraction en phase solide. La concentration de dopage lors de l'analyse est d'environ 2 ng/mL (selon la concentration de la solution mère).
*Se reporter à la section « Contrôle de la qualité » pour obtenir des explications au sujet de ces sigles.
- Préparation des étalons de travail
- Solution mère primaire de B[a]P : Dissoudre 10 mg de B[a]P dans 50 mL d'acétonitrile.
- Solution mère secondaire : Pipetter 100 µL de solution mère primaire dans 50 mL d'acétonitrile.
Le tableau suivant résume l’ensemble des étalons de travail préparés, le volume de chaque solution mère secondaire, ainsi que le volume final correspondant et la concentration de chaque solution.
Étalons de travail Étalon No Volume de solution mère primaire (µL) Volume final (mL) Concentration [ng/mL] 1 40 25 0,6400 2 175 25 2,800 3 350 25 5,600 4 600 25 9,600 5 900 25 14,4 6 2 mL d'étal. 1 10 0,1280 7 4 mL d'étal. 1 10 0,2560
Il faut consigner tous les poids, tous les volumes et toutes les puretés et les utiliser pour calculer avec précision les concentrations des étalons. Celles-ci servent à établir la courbe d'étalonnage.
10 Échantillonnage
- L'échantillonnage des produits du tabac à analyser doit être fait conformément aux conditions définies dans la méthode T-115.
11 Préparation des produits du tabac
- Le conditionnement du produit doit être effectué conformément à la méthode T-115.
- La longueur de mégot des cigarettes, des équivalents-cigarettes, des bidis, des kreteks et des cigares doit être indiquée conformément à la méthode T-115.
- La préparation des cigarettes à être fumées dans des conditions intenses doit être effectuée conformément à la méthode T-115.
12 Préparation de la machine à fumer
- Conditions ambiantes
- Les conditions ambiantes de fumage doivent être conformes à celles de la méthode T-115.
- Conditions relatives à la machine à fumer
- Les conditions relatives à la machine à fumer doivent être conformes à celles de la méthode T-115.
13 Production des échantillons
- Les cigarettes doivent être fumées et la matière particulaire totale doit être piégée conformément aux conditions définies dans la méthode T-115.
Nota : Dans les conditions standard, on fume cinq cigarettes par analyse. Pour les autres produits du tabac, retenir un nombre tel que le filtre ne soit pas saturé.
Nota : Les échantillons peuvent être conservés à - 20 oC jusqu'à 10 jours avant leur extraction au cyclohexane.
14 Analyse des échantillons
- Extraction des tampons
- Retirer le tampon à fumée principale de tabac de son porte-filtre, le plier en quatre et nettoyer l'intérieur du porte-filtre avec le côté propre du tampon.
- Mettre le tampon dans un ballon.
- À l'aide d'une pipette, ajouter un volume de cyclohexane numériquement équivalent (arrondi à 10 mL près) à la quantité totale de MPT (en mg), volume minimal de 30 mL, dans le ballon, permettant d'obtenir une concentration
d'environ 1 mg de MPT/mL de cyclohexane. Consigner le volume de cyclohexane utilisé pour extraire le tampon.
- Exemple 1 : Si la quantité de MPT est égale à 70 mg (au total), utiliser 70 mL de cyclohexane.
- Exemple 2 : Si la quantité de MPT est égale à 83 mg (au total), utiliser 80 mL de cyclohexane.
- Exemple 3 : Si la quantité de MPT est égale à 57 mg (au total), utiliser 60 mL de cyclohexane.
- À l'aide d'un agitateur oscillant, agiter vigoureusement pendant 30 minutes le ballon contenant le tampon et le cyclohexane, jusqu'à ce que la solution semble homogène et que le tampon ne présente plus aucune tache colorée.
- Conserver ces ballons à l'obscurité jusqu'à ce qu'ils soient prêts à être traiter.
- Purification des échantillons
- Filtrer environ 8 mL de l'extrait au cyclohexane sur un filtre organique jetable en PTFE de 0,45µm et récupérer le filtrat dans un flacon de 7 mL muni d'un bouchon recouvert d'une feuille d'aluminium. Les échantillons peuvent alors être conservés à 4 oC si on laisse un espace de tête suffisant.
- Conditionner les cartouches de silice et de NH2 Plus avec de l'hexane, en suivant les recommandations du fabricant. Nota : S'assurer que tout l'air est enlevé de la cartouche et que le matériel absorbant est bien imbibé d'hexane.
- Placer les cartouches conditionnées sur le Visi-prep, ajouter environ 1 g de sulfate de sodium anhydre à la cartouche de silice et laver les cartouches avec 10 mL d'hexane, en laissant l'hexane s'écouler par gravité.
- Lorsque l'extrait a atteint la température ambiante, en pipetter une portion de 2 mL et la déposer sur le remplissage de la cartouche de silice.
- Laisser le cyclohexane s'écouler (par gravité) dans les cartouches à une vitesse d'environ une goutte/seconde. Jeter l'éluat.
- Pipetter 4 mL d'hexane sur la cartouche et les laisser s'écouler par gravité. Jeter l'éluat.
- Placer un tube à culture en verre jetable de 20 mL sous chaque cartouche.
- Éluer le B[a]P en laissant s'écouler par gravité quatre portions de 4 mL d'hexane dans les cartouches.
- Ajouter 1 mL de THF dans chaque tube.
- Placer les tubes contenant les 17 mL d'éluat sur un turbo-évaporateur Zymark.
Nota : Régler le turbo-évaporateur à une température de 40 oC et à une pression d'azote de 7,5 lb/po2. - Évaporer les échantillons jusqu'à siccité.
Nota : Cette opération nécessitera une période initiale de 20 minutes au cours de laquelle la pression d'azote peut être lentement haussée jusqu'à un maximum de 10,0 lb/po2, de manière à éviter toute perte d'échantillon par éclaboussement. - Retirer les échantillons complètement secs. Si certains échantillons ne sont pas complètement secs, poursuivre l'évaporation jusqu'à siccité par intervalles de 5 minutes à la fois.
- À l'aide d'une pipette, ajouter 1000 µL d'acétonitrile dans chaque tube sec pour dissoudre l'analyte et tout résidu présent.
- Agiter le tube à haute vitesse, en créant un tourbillon, pendant environ 15 secondes.
- À l'aide d'une pipette en verre, rincer les parois du tube cinq fois avec l'échantillon, puis transférer l'échantillon dans un flacon pour échantillonneur automatique Varian, muni d'un bouchon à vis et d'un septum recouvert de téflon.
- Les échantillons sont prêts pour le dosage par CLHP et peuvent être conservés à 4 oC jusqu'au moment de l'analyse.
- Appareil d'analyse : Analyse par chromatographie liquide haute performance (CLHP) en phase inversée
- Paramètres du détecteur de fluorescence Jasco
Longueur d'onde d'excitation : 365 nm.
Longueur d'onde d'émission : 425 nm.
Gain : × 1000.
Atténuation : 32.
Nota : Si on utilise un détecteur fluorimétrique d'une autre marque, il faudra peut-être le programmer différemment pour conserver la même plage d'étalonnage. Un léger réglage de la longueur d'onde d'excitation ou d'émission pourrait aussi s'avérer nécessaire, selon la marque de détecteur (p. ex., des longueurs d'onde de 366 et 424 nm). - Échantillonneur automatique : volume injecté
Utiliser une boucle d'échantillonnage de 50 µL et un réglage de volume injecté de 75 µL, afin d'assurer la purge complète de la boucle d'échantillonnage par l'échantillon. - Phase mobile et gradient (système ternaire à gradient)
Solvant A : Mélange 55/45 d'acétonitrile et de 1 % d'isopropanol dans de l'eau de type I (dégazé et filtré sur un filtre en nylon de 0,45 µm)
Solvant B : Méthanol.
Solvant C : Acétonitrile.
Débit : 1,5 mL/minute.
Gradient : Des ajustements peuvent être nécessaires selon la condition de la colonne et la résolution des analytes.
Le tableau suivant résume le pourcentage de séparation des solvants A, B et C à plusieurs points dans le temps de la chromatographie liquide haute performance. Les échantillons ont été collectés au début de l’analyse (0 minute) et à plusieurs intervalles entre 20 et 35 minutes après le début de l’analyse.
Phase mobile et gradient Temps (minutes) Composition % A % B % C 0,00 55 0 45 20,00 75 0 25 25,01 100 0 0 28,00 100 0 0 30,01 0 100 0 32,00 0 100 0 34,01 100 0 0 35,00 100 0 0 35,00 Fin de l'analyse : Équilibrer
Temps d'équilibrage : 8,00 minutes.
- Paramètres du détecteur de fluorescence Jasco
- Calculs
- Détermination du facteur de réponse (FR)
- Procéder à un premier étalonnage en analysant les étalons préparés; commencer par les concentrations élevées et progresser vers les concentrations faibles (injecter le tout premier étalon au moins deux fois jusqu'à l'obtention d'une réponse et d'un temps de rétention constants).
- Préparer une courbe d'étalonnage en traçant la concentration du B[a]P dans l'étalon en fonction de la hauteur du pic fourni par le détecteur de fluorescence.
- Le facteur de réponse est égal à la pente de la droite calculée par régression linéaire (hauteur / concentration).
- Calcul de la teneur en B[a]P [ng/cigarette]
B[a]P [ng/cigarette] =[ hauteur du pic × volume de liquide d'extraction (mL) × volume final (mL)] / [FR × nbre de cigarettes fumées × volume de la portion utilisée (mL)]
dans laquelle le volume de la portion utilisée (mL) est le volume transféré dans la cartouche Sep-pak, corrigé pour tenir compte de toute dilution préalable lors de l'étape de substitution de solvant. Le facteur de réponse est calculé à partir de la courbe d'étalonnage.
- Détermination du facteur de réponse (FR)
15 Contrôle de la qualité
- Chromatogramme typique
- Voir les annexes 1a et 1b.
- Paramètres de contrôle typiques
- Chaque série d'analyses doit comporter au moins un de chacun des éléments suivants (fumage sur les 20 canaux).
- Blanc de réactifs (BR) : pour déterminer la contamination de fond due aux solutions, à la verrerie ou aux matières utilisées lors de l'analyse.
- Blanc fortifié (BF) : pour déterminer s'il y a perte d'analyte lors de l'analyse.
- Matrice fortifiée (MF) par dopage de cigarettes de la marque témoin : pour déterminer s'il y a perte de l'analyte lors de l'analyse et pour déceler tout effet de matrice potentiel.
- Échantillon de référence : pour déterminer la reproductibilité de la méthode complète d'analyse d'une série d'analyses à l'autre.
- Échantillon en double : pour déterminer la reproductibilité de la méthode lors d'une même série d'analyses ou de l'analyse d'un même lot.
- Chaque série d'analyses doit comporter au moins un de chacun des éléments suivants (fumage sur les 20 canaux).
- Taux de récupération et niveaux de contamination
- Les taux de récupération typiques des blancs fortifiés (BF) et des matrices fortifiées (MF) se situent dans la gamme de 85 - 110 %, lorsqu'une solution (ou un échantillon) dopée est soumise au processus complet d'extraction.
- Des taux de récupération inférieurs à 85 % indiquent que l'élution du B[a]P par les cartouches d'extraction en phase solide est insuffisante ou qu'il y a eu changement du facteur de réponse (FR) du détecteur de fluorescence. Tout changement du FR doit d'abord être examiné avant de retraiter les échantillons.
- Les blancs de réactifs (BR) donnent typiquement des valeurs calculées allant de 0 à 0,3 ng/cig. Une contamination de cet ordre est en général associée à une contamination du tampon au cours du conditionnement ou à un nettoyage insuffisant de la verrerie.
- Limites de détection de la méthode (LDM) / limite de dosage (LDD)
- Déterminer la limite de détection de la méthode (LDM) en analysant l'étalon le moins concentré, comme s'il s'agissait d'un échantillon inconnu, au moins 10 fois sur une période de plusieurs jours. La LDM est égale à trois fois l'écart-type
de ces résultats.
Nota : On peut modifier la LDM (en ng/cigarette) en changeant le nombre de cigarettes fumées et les volumes utilisés pour l'extraction et la purification. - Déterminer la limite de dosage (LDD) pratique en analysant l'étalon le moins concentré, comme s'il s'agissait d'un échantillon inconnu, au moins 10 fois sur une période de plusieurs jours. La LDD est égale à 10 fois l'écart-type de ces résultats.
- Déterminer la limite de détection de la méthode (LDM) en analysant l'étalon le moins concentré, comme s'il s'agissait d'un échantillon inconnu, au moins 10 fois sur une période de plusieurs jours. La LDM est égale à trois fois l'écart-type
de ces résultats.
- Stabilité des réactifs et des échantillons
- Conserver les solutions mères et les étalons à - 20 °C.
- Les solutions mères, les étalons et les solutions de dopage sont stables pendant une période pouvant atteindre six mois. Il n'y a pas de perte d'analyte, mais la perte de solvant par évaporation peut constituer un problème.
- À tous les deux mois, préparer de nouvelles solutions d'étalonnage à partir de la solution mère.
- Les échantillons sont stables à 4 °C pendant trois semaines suivant l'extraction.
16 Modifications pour le fumage dans des conditions intenses
- Dans des conditions intenses de fumage, réduire le nombre de cigarettes par analyse à deux.
17 Références
- Dumont, J., Larocque-Lazure, F. et Iorio, C. An Alternative Isolation Procedure for the Subsequent Determination of Benzo[a]pyrene in Total Particulate Matter of Cigarette Smoke, Journal of Chromatographic Science, vol. 31, septembre 1993, p. 371-374.
- Tomkins, B.A., Jenkins, R.A., Griest, W.H. et Reagen, R.R. Liquid Chromatographic Determination of Benzo[a]pyrene in Total Particulate Matter of Cigarette Smoke, J. Assoc. Off. Anal. Chem., vol. 68, 1985, p. 935-940.
Annexes
Annexe 1a : Chromatogramme typique
La figure suivante est un chromatogramme typique, où sont superposés les courbes obtenues avec un étalon, une cigarette témoin à forte teneur en goudron et une cigarette témoin à faible teneur en goudron.
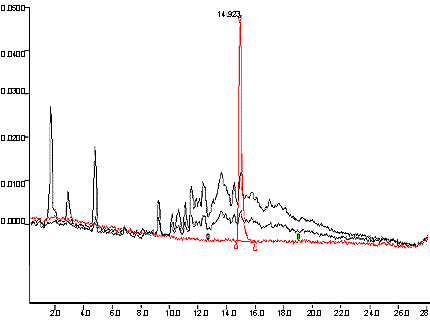
Superposition des chromatogrammes obtenus avec un étalon, avec une cigarette témoin à forte teneur en goudron et avec une cigarette témoin à faible teneur en goudron.
Annexe 1b : Chromatogramme typique
La figure suivante est une vue détaillée de la figure 1a qui illustre la ligne de base obtenue avec un échantillon réel.
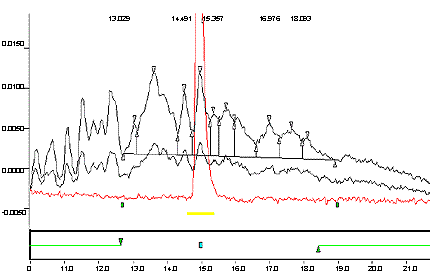
Agrandissement de la figure à l'annexe 1a montrant la ligne de base obtenue avec un échantillon véritable.