Dosage de certains carbonyles dans la fumée principale de tabac
Santé Canada
T-104 31 décembre 1999
Table des matières
- Portée
- Normes applicables
- Définitions
- Résumé de la méthode
- Appareillage et équipement
- Réactifs et matériel
- Préparation de la verrerie
- Préparation des solutions
- Préparation des étalons
- Échantillonnage
- Préparation des produits du tabac
- Préparation de la machine à fumer
- Production des échantillons
- Analyse des échantillons
- Contrôle de la qualité
- Modifications pour des conditions intenses de fumage
- Références
- Annexes
1 Portée
- La présente méthode s'applique au piégeage et au dosage des composés carbonylés volatils (sous la forme de 2,4-dinitrophénylhydrazones) dans la phase vapeur de la fumée principale de tabac. Elle ne s'applique qu'aux composés carbonylés extraits de la phase vapeur de la fumée principale de tabac et dosés dans la solution de piégeage de 2,4-dinitrophénylhydrazine (DNPH). La présente méthode s'applique à la fumée de tabac produite par les cigarettes et les cigares.
2 Normes applicables
- American Society for Testing and Materials (ASTM) : Méthode D 1193-77, Standard Specification for Reagent Water, Version 1977.
- Méthode d'analyse T-115 de Santé Canada : Dosage du goudron, de l'eau, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 1999-12-31.
3 Définitions
- Pour une définition des termes utilisés dans le présent document, se reporter à la méthode T-115.
4 Résumé de la méthode
- Le produit du tabac est fumé mécaniquement sur des canaux alternés d'une machine à fumer linéaire standard de 20 canaux, sur laquelle on a installé des flacons Drechsel ou des pièges à impacteurs frittés.
- Les carbonyles volatils sont extraits de la fumée principale de tabac non filtrée en faisant barboter chaque bouffée à travers un impacteur dans un piège contenant 80 mL d'une solution aqueuse acidifiée de 2,4-dinitrophénylhydrazine (DNPH) dans l'acétonitrile.
- Une portion de l'extrait de la réaction DNPH-fumée est ensuite filtrée dans une seringue et diluée avec une solution aqueuse de base Trizma à 1 % dans l'acétonitrile.
- Les échantillons sont analysés par chromatographie liquide à haute performance (CLHP) en phase inverse et dosés à l'aide d'un détecteur ultraviolet.
Nota : L'analyse et l'évaluation de certains produits à l'aide de cette méthode peuvent nécessiter l'utilisation de substances ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode normalisée, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte des règlements en vigueur.
La préparation des échantillons et leur analyse devraient être effectuées en une journée. Les solvants contaminés obtenus lors de l'analyse par CLHP doivent être conservés afin d'être ultérieurement éliminés par une firme autorisée à recycler les produits chimiques.
5 Appareillage et équipement
- Équipement nécessaire au conditionnement, tel que défini dans la méthode T-115.
- Équipement nécessaire au marquage de la longueur des mégots, tel que défini dans la méthode T-115.
- Équipement nécessaire au fumage mécanique des produits du tabac, tel que défini dans la méthode T-115.
- Agitateur oscillant.
- Erlenmeyers de 150 mL à joints en verre rodé.
- 12 Porte-cigarettes en verre (longueur : 6,5 cm et diamètre interne : 8,0 mm).
- 12 Pièges en verre de type Drechsel (volume de 250 mL) avec impacteurs frittés EC.
- Tubes en Nalgène, ¼ po d.i. × 3/8 po d.e..
- Balance précise à au moins quatre places décimales.
- Fioles jaugées - 10 mL, 25 mL, 1 L et 2 L.
- Micropipettes en verre - divers volumes (100, 150, 300, 400, 500, 800, 1000 et 2000 µL).
- Pipettes en verre (pour transvider) - 1, 2, 5, 6, 7, 8 et 20 mL.
- Éprouvettes graduées, en verre - 25 et 50 mL.
- Plaque chauffante à agitation magnétique.
- Système de chromatographie liquide à haute pression, contrôlé par ordinateur personnel, composé des éléments suivants :
- Pompe pour gradient ternaire.
- Échantillonneur automatique avec boucle d'échantillonnage de 50 µL.
- Détecteur UV.
- Système de cueillette des données.
- Colonne : Merck Lichrosphere, 250 × 4 mm, 100, RP 18e (5 µm), ou l'équivalent.
- Colonne de garde jetable : Lichrocart, 4 × 4 mm, Lichrosphere RP 18e (5 µm), ou l'équivalent.
- Filtre à vide.
- Fioles ambrées, 1 et 4 L.
- Dessiccateur.
6 Réactifs et matériel
Nota : Tous les réactifs doivent être, au minimum, des réactifs de qualité analytique.
- Méthanol - DIG (« Distilled-in-glass »).
- Acétonitrile - DIG.
- Isopropanol - DIG.
- Acétate d'éthyle - DIG.
- Tétrahydrofurane (THF) - DIG.
- Alcool de qualité réactif - Qualité CLHP.
- Acide perchlorique (60 %).
- Acide chlorhydrique (35 %).
- Acide sulfurique concentré (H2SO4).
- Eau de type I (tel que décrite dans la méthode ASTM D1193).
- Solution de formaldéhyde - 37-41 % (p/v).
- Acétaldéhyde - pureté > 99 %.
- Acétone - DIG.
- Acroléine - pureté > 99 %.
- Propionaldéhyde - pureté > 97 %.
- Crotonaldéhyde - pureté > 99+ %.
- Méthyléthylcétone - pureté > 99+ %.
- Isobutyraldéhyde - pureté > 99 %.
- Butyraldéhyde - pureté > 99+ %.
- Base Trizma.
- 2,4-dinitrophénylhydrazine (DNPH).
- Filtre à seringue - 0,45 µm PVDF, ou l'équivalent.
- Seringues jetables - 5 cm3.
- Pipettes Pasteur jetables, en verre.
- Poires en caoutchouc.
- Flacons pour échantillonneur automatique (ambrés), bouchons, septums garnis de téflon.
- Ruban cache.
- Parafilm®, ou l'équivalent.
- Hélium - qualité UHP.
7 Préparation de la verrerie
- Le lavage et le séchage de la verrerie doivent être effectués de manière à ce que celle-ci ne cause pas de contamination.
- Il est extrêmement important d'éliminer toute source potentielle de contamination, par exemple les flacons-laveurs contenant de l'acétone, de la zone de travail.
8 Préparation des solutions
- Préparation de la solution de DNPH
- Peser 6,792 g (24,0 mmol) de 2,4-dinitrophénylhydrazine (DNPH) disponible sur le marché. Ajouter à 1 L d'acétonitrile frais dans une fiole jaugée de 2 L. Dissoudre la DNPH en agitant légèrement d'un mouvement rotatif, puis en chauffant la fiole. S'assurer qu'il ne reste aucun cristal avant de passer à l'étape suivante. (Attention! Ne pas traiter par sonification).
- Une fois la DNHP entièrement dissoute, ajouter 5,6 mL d'acide perchlorique à 60 % en agitant légèrement. La solution se colorera en jaune.
- Compléter au trait avec de l'eau de type I. L'ajout de l'eau colorera la solution en orange vif.
- Transvider la solution dans une fiole ambrée de 4 L et la conserver à la température ambiante, à l'obscurité, afin d'éviter la précipitation de DNHP. Cette solution, conservée dans un contenant étanche et dans ces conditions, sera stable pendant une semaine.
- Préparation de la solution de dilution de base Trizma (80 /20, MeCN/solution aqueuse de Trizma à 1 %)
- Dissoudre 2,00 g de base Trizma dans 200 mL d'eau distillée désionisée (eau de type I) dans une fiole jaugée de 1 L. Compléter au trait avec de l'acétronitrile.
- Transvider la solution dans une fiole ambrée de 1 L à bouchon revêtu de téflon et conserver à la température ambiante. Cette solution devrait être stable pendant plusieurs semaines dans ces conditions.
9 Préparation des étalons
- Préparation des dérivés dinitrophénylhydrazone
- Dissoudre 600 mg de DNHP disponible sur le marché dans 2 mL de H2SO4 concentré, dans un erlenmeyer de 50 mL.
- Ajouter 3 mL d'eau de type I, tout en agitant avec une tige de verre (la solution doit être transparente). Ajouter ensuite 10 mL d'alcool de qualité réactif.
- Ajouter la solution de DNPH à une solution de chacun des aldéhydes ou cétones appropriés :
120 mg de formaldéhyde
50 mg d'acétaldéhyde
40 mg d'acétone
40 mg d'acroléine
40 mg de propionaldéhyde
35 mg de crotonaldéhyde
33 mg de méthyléthylcétone
33 mg de butyraldéhyde.
Habituellement, la cristallisation s'amorce assez rapidement. - Filtrer les cristaux d'hydrazone sous vide et les rincer avec de l'alcool de qualité réactif froid (4 °C).
- Recristallisation des hydrazones : ajouter environ 10 mL d'alcool de qualité réactif aux cristaux dans un petit erlenmeyer, chauffer, puis ajouter 3 mL d'acétate d'éthyle, goutte à goutte, pour dissoudre les cristaux. Ramener la solution à la température ambiante.
- Filtrer les cristaux sous vide, les rincer avec de l'alcool de qualité réactif froid (4 °C), les sécher à l'air et les conserver dans des fioles au dessiccateur, à -20 °C.
- Étalons et solutions de travail pour l'analyse par CLHP
- Étalons primaires (1°) de carbonyles
- Peser les quantités d'hydrazones purifiées indiquées à l'annexe 1(a). Les introduire dans des fioles jaugées individuelles de 25 mL et les dissoudre dans de l'acétonitrile. La concentration indiquée est celle de l'aldéhyde libre.
- Sceller les fioles avec du Parafilm et les garder au froid à 4 °C. Les solutions sont stables pendant une période pouvant atteindre un an si elles sont conservées dans des conditions appropriées
- Étalons secondaires (2°) de carbonyles
- Pipetter des volumes prédéterminés de chacune des solutions étalons primaires d'hydrazones dans une seule fiole jaugée de 25 mL et diluer jusqu'au trait avec de l'acétonitrile.
- Sceller la fiole avec du Parafilm et garder au froid à 4 °C. Préparer de nouvelles solutions à tous les 20 jours (voir l'annexe 1(a)).
- Étalons de travail de carbonyles
- Mesurer des volumes appropriés (0,050 à 7,5 mL) des solutions étalons secondaires de carbonyles et diluer jusqu'à 10 mL avec de l'acétonitrile pour obtenir des étalons dont les concentrations sont dans les intervalles indiqués à l'annexe 1(b).
- Transvider une partie des solutions dans des flacons pour échantillonneur automatique.
- Préparer de nouveaux étalons de carbonyles à tous les 20 jours.
- Solutions de dopage de carbonyles (voir l'annexe 1(c))
- Pipetter des volumes prédéterminés de chacune des solutions étalons primaires d'hydrazones dans une seule fiole jaugée de 25 mL et diluer en complétant jusqu'au trait avec de l'acétonitrile.
- Préparer de nouvelles solutions à tous les 20 jours.
- Étalons primaires (1°) de carbonyles
10 Échantillonnage
- L'échantillonnage des produits du tabac pour des analyses doit être effectué conformément à la méthode T-115.
11 Préparation des produits du tabac
- Le conditionnement du produit doit être effectué conformément à la méthode T-115.
- La longueur de mégot des cigarettes, des équivalents-cigarettes, des bidis, des kreteks et des cigares doit être indiquée conformément à la méthode T-115.
- La préparation des cigarettes à être fumées dans des conditions intenses doit être effectuée conformément à la méthode T-115.
12 Préparation de la machine à fumer
- Conditions ambiantes
- Les conditions ambiantes de fumage doivent être celles décrites à la méthode T-115.
- Conditions relatives à la machine à fumer
- Les conditions relatives à la machine à fumer doivent être celles décrites à la méthode T-115 (sauf pour les modifications ci-après) :
- Il est important de s'assurer que la fumée principale de tabac est caractéristique de l'échantillon analysé avant de procéder à l'analyse. La matière particulaire totale (MPT) de la fumée principale de tabac n'étant pas filtrée et le tampon-filtre étant absent, il faut donc utiliser l'information sur le nombre de bouffées pour caractériser les échantillons d'extrait de fumée et pour contrôler le processus de fumage.
- Assembler l'appareillage servant à doser les carbonyles dans la fumée principale de tabac sur 12 canaux alternés de la machine à fumer linéaire, sans utiliser les tampons-filtres et les porte-filtres.
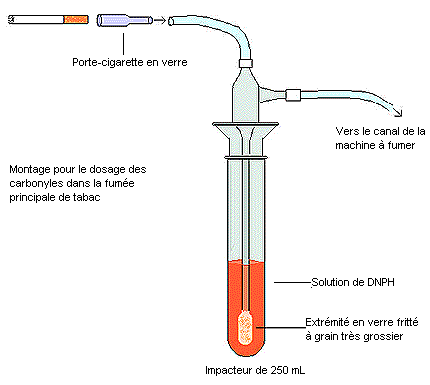
- Raccorder la partie arrière d'un porte-cigarette spécial en verre (6,5 cm (longueur) par 8,0 mm (d.i.)), à l'aide d'un tube en Nalgène, à l'impacteur de 250 mL et au piège. Voir la figure ci-après.
- Vérifier et régler les volume des bouffées tirées par la machine à fumer à chacun des 12 canaux, selon les instructions de la méthode T-115. Les volumes sont vérifiés à l'extrémité du canal où se trouve la cigarette (l'impacteur fritté et le piège à DNPH étant branchés directement) à l'aide de la pièce de restriction en laiton.
- Utiliser le même impacteur pour étalonner chaque canal avant l'étape de fumage. Une fois les volumes de bouffées vérifiés et réglés, jeter la solution de DNPH.
- Ajouter 80 mL d'une solution inutilisée de DNPH dans chaque impacteur.
13 Production des échantillons
- Les cigarettes (deux cigarettes* par essai) doivent être fumées conformément à la méthode T-115.
*Pour l'analyse d'autres produits du tabac, choisir un nombre de produits tel que les filtres pourront piéger toute la matière solide.
14 Analyse des échantillons
- Solutions d'extrait de la fumée principale
- Une série d'analyses comprend 12 échantillons d'extrait de fumée ayant réagi avec la DNPH. Traiter 12 échantillons à la fois, mais pas plus que deux séries, soit 24 échantillons, par jour. Ne pas fumer plus d'échantillons que le nombre pouvant être analysés en 24 heures.
- Rincer le porte-cigarette et le tube en Nalgène avec la solution dans l'impacteur en refoulant celle-ci dans les conduits de l'impacteur jusqu'au porte-cigarette en verre (à l'aide d'une pression positive), puis en aspirant de l'air dans la solution (à l'aide d'une pression négative).
- Répéter cette étape de rinçage au moins trois fois pour chaque impacteur afin de dissoudre tout condensat de fumée présent dans les conduits de gaz.
- Laisser reposer la solution d'extrait de fumée ayant réagi avec la DNPH pendant au moins cinq minutes avant tout traitement ultérieur des échantillons.
- Pipetter 6 mL de la solution de base Trizma à 1 % dans une fiole jaugée de 10 mL.
- Ajouter 4 mL de la solution extrait de fumée/DNHP filtrée à la seringue à la fiole jaugée.
- Bien agiter la fiole jaugée. Transvider deux portions de cette solution, à l'aide d'une pipette Pasteur, dans deux flacons pour échantillonneur automatique (échantillons dédoublés a et b). (Rincer d'abord chaque flacon avec quelques gouttes de la solution, puis les remplir de façon à obtenir l'espace libre le plus faible possible).
- Boucher les flacons à l'aide de septums garnis de téflon et les conserver à 4 °C jusqu'à l'analyse.
- Répéter les étapes 14.1.5 à 14.1.8 pour chaque échantillon d'extrait de fumée.
- Préparation de témoins et des blancs
- Préparer au moins un blanc de réactifs (BR), un blanc fortifié (BF) et une matrice fortifiée (MF) à chaque jour de travail, selon les instructions suivantes, afin de s'assurer que le système d'analyse, la verrerie et les réactifs ne constituent pas des sources de perturbation.
- Blanc de réactifs (BR)
- Pipetter 6 mL de la solution de dilution de base Trizma à 1 % dans une fiole jaugée de 10 mL.
- Ajouter 4 mL de solution filtrée de DNPH inutilisée à la fiole jaugée. Boucher et bien mélanger.
- Transvider dans deux flacons pour échantillonneur automatique (a et b), boucher et conserver à 4 °C jusqu'à l'analyse.
- Blanc fortifié (BF)
- Ajouter 1 mL de la solution de dopage de carbonyles et 79 mL de solution de DNPH à l'impacteur de 250 mL. Bien mélanger.
- Pipetter 6 mL de la solution de dilution de base Trizma à 1 % dans une fiole jaugée de 10 mL.
- Ajouter 4 mL de la solution mixte filtrée de DNPH/solution de dopage (section 14.4.1) à la fiole. Boucher et bien mélanger.
- Transvider dans deux flacons pour échantillonneur automatique (a et b), boucher et conserver à 4 °C jusqu'à l'analyse.
- Matrice fortifiée (MF)
- Pipetter 5 mL de la solution de dilution de base Trizma à 1 % dans une fiole jaugée de 10 mL.
- Ajouter 1 mL de la solution de dopage de carbonyles.
- Ajouter 4 mL de la solution filtrée de DNPH/extrait de fumée provenant d'une marque témoin à la fiole jaugée. Boucher et bien mélanger.
- Transvider dans deux flacons pour échantillonneur automatique (a et b), boucher et conserver à 4 °C jusqu'à l'analyse.
- Chromatographie liquide à haute performance en phase inverse
- Conditions d'analyse chromatographique
- Température de la colonne : 30 °C
- Volume d'injection : 20 µL
- Longueur d'onde, détection UV : 365 nm
- Phase mobile : Réactifs
Solvant A : Préparer deux litres d'une solution contenant 30 % d'acétonitrile, 10 % de THF et 1 % d'isopropanol dans de l'eau de type I; filtrer et dégazer (barbotage avec de l'hélium de qualité UHP).
Solvant B : Préparer deux litres d'une solution contenant 65 % d'acétonitrile, 1 % de THF et 1 % d'isopropanol dans de l'eau de type I; filtrer et dégazer (barbotage avec de l'hélium de qualité UHP). Solvant C : Acétonitrile (barbotage avec de l'hélium de qualité UHP). - Solution de lavage pour échantillons : Solvant A
- Phase mobile : Gradient
Débit : 1,5 mL/minute Temps (minutes) Composition % A % B % C 0,0 100 0 0 8,0 70 30 0 20,0 47 53 0 27,0 0 100 0 30,0 0 0 100 32,0 0 0 100 34,0 95 5 0 Conditions de fin de méthode 100 0 0 (Équilibrer pendant 10 minutes).
- Charger les flacons contenant les échantillons sur l'échantillonneur automatique de façon qu'il y ait une solution étalon à tous les huit flacons; de plus, la durée totale de l'analyse (sections 14.1-14.6) ne doit pas dépasser 24 heures.
- Prélever 20 µL du flacon (a) de chaque échantillon et injecter sur la colonne CLHP; effectuer l'analyse selon les conditions d'analyse chromatographique telles que décrites à la section 14.6.1. Le flacon (b) est l'échantillon de réserve qui pourra être utilisé en cas de problème.
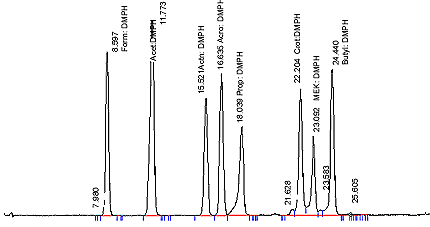
- Les chromatogrammes devraient ressembler à celui de la figure 1.
- Conditions d'analyse chromatographique
- Calculs
- Préparation d'une courbe d'étalonnage
- Injecter 20 µL de chaque solution étalon sur la colonne du système CLHP et analyser selon les conditions d'analyse chromatographique décrites à la section 14.6.1. Effectuer l'analyse en double. Les chromatogrammes devraient ressembler à celui de la figure 2.
- Détermination du facteur de réponse
- Préparer une courbe d'étalonnage pour chacun des composés carbonylés en traçant la concentration des étalons en fonction de l'aire sous les pics correspondants.
- Calculer les facteurs de réponse pour chacun des composés carbonylés à partir des courbes d'étalonnage.
- Dosage des échantillons
- Doser les différents composés carbonylés dans les échantillons de fumée par la méthode de l'étalon externe. Identifier les pics par comparaison de leurs temps de rétention avec ceux des étalons et des échantillons de fumée dopés.
- Les concentrations de carbonyles sont calculées par le logiciel et présentées en µg/mL.
- Détermination de la teneur en carbonyles de la fumée principale de tabac [en µg/cigarette] :
Composé carbonylé [µg/cigarette] = [Aire sous le pic/ Facteur de réponse] × [FD/ Nbre de cigarettes]
où FD représente le facteur de dilution. Le facteur de réponse doit être déterminé à partir de la courbe d'étalonnage.
- Préparation d'une courbe d'étalonnage
15 Contrôle de la qualité
- Chromatogramme typique
- Voir les figures 1 et 2.
- Taux de récupération et niveaux de contamination
- Chaque série d'analyses doit comprendre :
Un blanc de réactifs (BR) pour évaluer l'importance des perturbations dues à la verrerie, aux réactifs de piégeage, aux tampons-filtres en fibre de verre et aux effets du système d'analyse.
Une matrice fortifiée (MF) pour évaluer l'importance des pertes possibles d'analyte.
L'analyse d'un étalon, comme s'il s'agissait d'un échantillon, pour vérifier les calculs et valider l'étalonnage.
- Chaque série d'analyses doit comprendre :
- Limite de détection de la méthode (LDM) et limite de dosage (LDD)
- Limite de détection de la méthode (LDM)
- Déterminer la limite de détection de la méthode en analysant l'étalon le moins concentré, comme s'il s'agissait d'un échantillon, au moins 10 fois sur une période de plusieurs jours. La LDM est égale à trois fois l'écart-type de ces résultats.
- Limite de dosage (LDD)
- Déterminer la limite de dosage en analysant l'étalon le moins concentré, comme s'il s'agissait d'un échantillon, au moins 10 fois sur une période de plusieurs jours. La LDD est égale à 10 fois l'écart-type de ces résultats.
- Limite de détection de la méthode (LDM)
- Stabilité des réactifs et des échantillons
- Préparer toutes les solutions étalons primaires de carbonyles selon les besoins.
- Préparer de nouvelles solutions étalons de travail à tous les 20 jours.
- Analyser tous les échantillons dès qu'ils ont passé l'étape de la préparation et en moins de quatre heures.
16 Modifications pour le fumage dans des conditions intenses
- Aucune modification n'est nécessaire pour des conditions intenses de fumage.
17 Références
Publications connexes
- Houlgate, P. R., Dhingra, K. S., Nash, J. S. et Evans, W. H. Determination of Formaldehyde and Acetaldehyde in Mainstream Cigarette Smoke by high-performance Liquid Chromatography, Analyst, 114, 1989, p. 355-360.
- Manning, D.L., Maskerinec, M.P., Jenkins, R. A. et Marshall, A.H. High Performance Liquid Chromatographic Determinations of Selected Gas Phase Carbonyls in Tobacco Smoke, Journal of Assoc. of Anal. Chem., 66, p. 8-12.
Annexes
Annexe 1 - Solutions étalons typiques
(a) : Solutions-mères étalons
Ce tableau présente un sommaire des solutions mères étalons primaires et secondaires pour les analytes cibles, à savoir : formaldéhyde, acétaldéhyde, acétone, acroléine, propionaldéhyde, crotonaldéhyde, méthyléthylcétone et butyraldéhyde. Il indique la masse moléculaire avec l’hydrazone, la masse moléculaire du carbonyle, le poids, la pureté et le volume de l’échantillon, ainsi que les concentrations de solution pour les étalons primaires. Enfin, le tableau résume les renseignements sur les étalons secondaires dilués, y compris le volume des étalons primaires initiaux, le volume final et la concentration des solutions mères.
| Carbonyl Hydrazone |
Étalon primaire | Étalon secondaire* | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Masse mol. Hydrazone |
Masse mol. Carbonyle |
Poids (mg) |
Pureté % |
Volume (mL) |
Sol.- mère [µg/mL] |
Vol. (mL) Étalon prim. |
Diluer à : vol. (mL) |
Sol.-mère [µg/mL] |
|
| Formaldéhyde | 211,2 | 30,03 | 39,72 | 100 | 25 | 225,879 | 0,5 | 25 | 4,51758 |
| Acétaldéhyde | 225,14 | 44,05 | 53,9 | 100 | 25 | 421,834 | 1,0 | 25 | 16,87338 |
| Acétone | 239,17 | 58,08 | 31,2 | 100 | 25 | 303,064 | 0,75 | 25 | 9,09192 |
| Acroléine | 237,15 | 56,06 | 32,27 | 100 | 25 | 305,133 | 0,5 | 25 | 6,10266 |
| Propionaldéhyde | 239,17 | 58,08 | 31,18 | 100 | 25 | 302,87 | 0,5 | 25 | 6,0574 |
| Crotonaldéhyde | 251,18 | 70,09 | 27,37 | 100 | 25 | 305,496 | 0,5 | 25 | 6,10992 |
| MÉC | 253,2 | 72,11 | 27,43 | 100 | 25 | 312,477 | 0,5 | 25 | 6,24953 |
| Butyraldéhyde | 253,2 | 72,11 | 23,28 | 100 | 25 | 265,201 | 0,5 | 25 | 5,30402 |
*Une seule fiole jaugée de 25 mL complétée au trait avec de l'acétonitrile.
(b): Étalons de travail
Ce tableau présente un sommaire des étalons de travail de carbonyles, à savoir les concentrations pour les étalons de 5, 20, 40, 80, 200, 400, 700 et 1 000 µg/mL. La concentration correspondante des analytes cibles du tableau a est indiquée.
| 5 | 20 | 40 | 80 | 200 | 400 | 700 | 1000 | |
|---|---|---|---|---|---|---|---|---|
| Vol. (ml) W/S | 0,050 | 0,200 | 0,400 | 0,800 | 2,000 | 4,000 | 7,000 | 10,000 |
| Carbonyl | [μg/mL] | [μg/mL] | [μg/mL] | [μg/mL] | [μg/mL] | [μg/mL] | [μg/mL] | [μg/mL] |
| Formaldéhyde | 0,0226 | 0,0904 | 0,1807 | 0,3614 | 0,9035 | 1,8070 | 3,1623 | 4,5176 |
| Acétaldéhyde | 0,0844 | 0,3375 | 0,6749 | 1,3499 | 3,3747 | 6,7494 | 11,8114 | 16,8734 |
| Acétone | 0,0455 | 0,1818 | 0,3637 | 0,7274 | 1,8184 | 3,6368 | 6,3643 | 9,0919 |
| Acroléine | 0,0305 | 0,1221 | 0,2441 | 0,4882 | 1,2205 | 2,4411 | 4,2719 | 6,1027 |
| Propionaldéhyde | 0,0303 | 0,1211 | 0,2423 | 0,4846 | 1,2115 | 2,4230 | 4,2402 | 6,0574 |
| Crotonaldéhyde | 0,0305 | 0,1222 | 0,2444 | 0,4888 | 1,2220 | 2,4440 | 4,2769 | 6,1099 |
| MEK | 0,0312 | 0,1250 | 0,2500 | 0,5000 | 1,2499 | 2,4998 | 4,3747 | 6,2495 |
| Butyraldéhyde | 0,0265 | 0,1061 | 0,2122 | 0,4243 | 1,0608 | 2,1216 | 3,7128 | 5,3040 |
**Préparés dans des fioles jaugées de 10 mL complétées au trait avec de l'acétonitrile.
(c): Solutions de dopage
Ce tableau présente un sommaire des renseignements sur les solutions de dopage. Il indique le volume et la concentration de la solution mère et de la solution dopée, ainsi que la concentration analysée dans chacun des analytes suivants : formaldéhyde, acétone, butyraldéhyde, et butyraldéhyde total.
| Carbonyl | Solution de dopage de blanc fortifié (BF) *** | |||||
|---|---|---|---|---|---|---|
| Niveau Niveau de la | Sol-mère [µg/mL] |
Volume (mL) |
Diluer à : Vol. (mL) |
Dopage [µg/mL] |
Tel que [µg/mL] |
|
| Formaldéhyde | Primaire | 225,879 | 1,4 | 31,62307 | 0,11294 | |
| Acétone | Primaire | 303,064 | 1,0 | 10,0 | 30,30641 | 0,10824 |
| Butyraldéhyde | Primaire | 265,201 | 1,0 | 26,52008 | 0,09471 | |
| Butyraldéhyde total | 47,68601 | 0,1703 | ||||
*** Dans une seule fiole jaugée de 10 mL complétée au trait avec de l'acétonitrile.
Figure 1 : Chromatogramme des carbonyles volatils dans un extrait à la DNPH de la fumée principale de tabac
La figure suivante est un chromatogramme analytique des carbonyles volatils (sous la forme de 2,4-dinitrophénylhydrazone) dans un extrait de fumée principale de tabac.
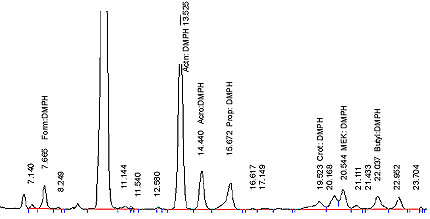
Figure 2 : Chromatogramme d'un mélange typique de solutions étalons de carbonyles
La figure suivante est un chromatogramme d’un mélange d’étalons de carbonyles.