Dosage de certains composés semi-volatils basiques (pyridine, quinoléine et styrène) dans la fumée principale de tabac
Santé Canada
T-112 31 décembre 1999
Table des matières
- Portée
- Normes applicables
- Définitions
- Résumé de la méthode
- Appareillage et équipement
- Réactifs et matériel
- Préparation de la verrerie
- Préparation des solutions
- Préparation des étalons
- Échantillonnage
- Préparation des produits du tabac
- Préparation de la machine à fumer
- Production des échantillons
- Analyse des échantillons
- Contrôle de la qualité
- Modifications pour des conditions intenses de fumage
- Références
- Annexes
1 Portée
- La présente méthode s'applique à la séparation et au dosage (par chromatographie en phase gazeuse avec détection par spectrométrie de masse (CG/SM)) de la pyridine, de la quinoléine et du styrène dans la fumée principale de tabac.
2 Normes applicables
- Méthode T-115 de Santé Canada : Dosage du goudron, de l'eau, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 1999-12-31.
3 Définitions
- Pour une définition des termes utilisés dans le présent document, se reporter à la méthode T-115.
4 Résumé de la méthode
- On piège la pyridine, le styrène et la quinoléine en faisant passer la fumée principale de tabac provenant de 20 cigarettes* dans un tampon-filtre en fibre de verre de 92 mm, puis dans des pièges cryogéniques contenant du méthanol. Le tampon-filtre est placé dans un erlenmeyer auquel on ajoute un étalon interne. Le tampon est extrait dans les solutions de piégeage et les extraits sont analysés par chromatographie en phase gazeuse avec détection par spectrométrie de masse (CG/SM).
*Pour l'analyse d'autres produits du tabac, choisir un nombre de produits tel que les filtres pourront piéger toute la matière solide.
Nota : L'analyse et l'évaluation de certains produits à l'aide de cette méthode d'essai peuvent nécessiter l'utilisation de substances ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode d'essai, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte des règlements en vigueur.
5 Appareillage et équipement
- Équipement nécessaire au fumage mécanique et au dosage, tel que défini dans la méthode T-115.
- Équipement nécessaire au conditionnement des produits du tabac, tel que défini dans la méthode T-115.
- Équipement nécessaire au marquage de la longueur des mégots, tel que défini dans la méthode T-115.
- Balance précise à au moins quatre places décimales.
- Impacteurs en verre, 70 mL, avec frittés à grain extra-gros.
- Tubes en tygon et raccords.
- Bouteilles Dewar.
- Thermomètre (-100 à 40 °C).
- Erlenmeyers de 125 mL, en polyméthylpentène (PMP), avec bouchons à vis, ou l'équivalent.
- Éprouvette graduée, capacité de 20 mL.
- Agitateur oscillant.
- Fioles jaugées de 10, 25, 50 et 100 mL.
- Pipettes jaugées ou seringues étanches aux gaz, de 100 à 1000 µL.
- Flacons pour autoéchantillonneur, avec bouchons et septums garnis de téflon.
- Système CG/SM Varian Saturn I, comprenant autoéchantillonneur modèle 8100, CG modèle 3400 avec injecteur à débit divisé/non-divisé modèle 1077 et détecteur à piège ionique (ITD), ou l'équivalent.
- Colonne Supelcowax, 30 m × 0,25 mm × 0,25 µm (ou l'équivalent), avec ligne de transfert en silice fondue désactivée, 1 m × 0,25 mm.
6 Réactifs et matériel
Nota : Tous les réactifs doivent être, au minimum, des réactifs de qualité analytique.
- Glace carbonique (glace sèche).
- Isopropanol.
- Méthanol (distillé en verre).
- D5 - Pyridine (pureté égale ou supérieure à 98 %).
- D7 - Quinoléine (pureté égale ou supérieure à 98 %).
- Pyridine.
- Quinoléine.
- Styrène.
- Seringues jetables, 5 cm3.
- Filtres à seringue - 0,45 µm, en PTFE, 25 mm, ou l'équivalent.
7 Préparation de la verrerie
- Le lavage et le séchage de la verrerie doivent être effectués de manière à ce que celle-ci ne cause pas de contamination.
8 Préparation des solutions
- Sans objet.
9 Préparation des étalons
- Préparer un étalon primaire de pyridine en pesant avec précision environ 100 mg de pyridine dans une fiole jaugée de 10 mL. Compléter avec du méthanol et bien mélanger. [Concentration : environ 10 mg/mL].
- Préparer un étalon primaire de quinoléine en pesant avec précision environ 100 mg de quinoléine dans une fiole jaugée de 100 mL. Compléter avec du méthanol et bien mélanger. [Concentration : environ 1 mg/mL].
- Préparer un étalon primaire de styrène en pesant avec précision environ 100 mg de styrène dans une fiole jaugée de 10 mL. Compléter avec du méthanol et bien mélanger. [Concentration : environ 10 mg/mL].
- Préparer un étalon secondaire mixte en transvidant 100 µL de chaque étalon primaire dans une fiole jaugée de 50 mL; compléter avec du méthanol et bien mélanger. [Concentrations : environ 20, 2 et 20 µg/mL, respectivement].
- Préparer un étalon interne de D5-pyridine en pesant avec précision 100 mg de D5-pyridine dans une fiole jaugée de 10 mL; compléter avec du méthanol et bien mélanger.
- Préparer un étalon interne de D7-quinoléine en pesant avec précision 25 mg de D7-quinoléine dans une fiole jaugée de 25 mL; compléter avec du méthanol et bien mélanger.
- Préparer une solution de dopage d'étalon interne (ÉI) en diluant 2 mL de chacun des étalons internes jusqu'à 100 mL avec du méthanol; bien mélanger. Conserver des portions de cette solution de dopage dans des flacons de 25 mL munis d'un bouchon garni de téflon, à une température de -20 °C. [Concentrations : environ 200 et 20 µg/mL, respectivement].
- Préparer cinq solutions étalons en transvidant une portion de 100 µL de solution de dopage ÉI dans cinq fioles jaugées de 10 mL. Rincer les parois avec du méthanol, puis ajouter les portions appropriées (par exemple, 2,1, 0,5, 0,25 et 0,1 mL) d'étalon secondaire dans chaque fiole. Compléter avec du méthanol et bien mélanger.
- Transvider les solutions dans une série de flacons pour autoéchantillonneur munis d'une étiquette, les boucher avec des septums garnis de téflon et les conserver à une température de -20 °C.
- Nota : Chaque flacon n'est utilisé qu'une seule fois.
10 Échantillonnage
- L'échantillonnage des produits du tabac pour des analyses doit être effectué conformément à la méthode T-115.
11 Préparation des produits du tabac
- Le conditionnement du produit doit être effectué conformément à la méthode T-115.
- La longueur de mégot du produit doit être indiquée conformément à la méthode T-115.
- La préparation des cigarettes à être fumées dans des conditions intenses doit être effectuée conformément à la méthode T-115.
12 Préparation de la machine à fumer
- Conditions ambiantes
- Les conditions ambiantes de fumage doivent être celles décrites à la méthode T-115.
- Conditions relatives à la machine à fumer
- Les conditions relatives à la machine à fumer doivent être celles décrites à la méthode T-115, sauf pour les modifications ci-après, relatives à une machine à fumer rotative (illustrée ci-dessous).
Cette figure présente le montage d’un dispositif pour la production et la collecte d’échantillons. Une pompe pneumatique est connectée à une machine à fumer à 20 canaux. La phase gazeuse est recueillie dans des impacteurs immergés dans un bain de bouillie de glace sèche/isopropanol. Les filtres Cambridge de 92 mm servent à retenir la phase particulaire.

- Verser 20 mL de méthanol dans chaque impacteur.
- Plonger les impacteurs dans un bain de glace sèche-isopropanol (température égale ou inférieure à -70 °C).
- Insérer un porte-filtre muni d'un tampon dans la seringue de la machine à fumer; relier deux impacteurs en série au porte-filtre. Relier le premier impacteur au gros porte-filtre de 92 mm.
- Les conditions relatives à la machine à fumer doivent être celles décrites à la méthode T-115, sauf pour les modifications ci-après, relatives à une machine à fumer rotative (illustrée ci-dessous).
13 Production des échantillons
- 13.1 Le piégeage de la MPT doit être effectué conformément à la méthode T-115.
14 Analyse des échantillons
- Extraction des tampons-filtres
- Découper le tampon de 92 mm en quatre morceaux et mettre les morceaux dans un erlenmeyer propre de 125 mL (en PMP). Ajouter 400 µL de solution de dopage ÉI au tampon.
- Transvider le contenu du premier impacteur dans la fiole. Rincer le premier impacteur avec le contenu du second impacteur et transvider le liquide de rinçage dans la fiole.
- Boucher la fiole et agiter sur l'agitateur oscillant pendant 30 minutes.
- Verser 4 mL de la solution dans une seringue de 5 mL munie d'un filtre à seringue.
- Remplir jusqu'à la base du col deux flacons pour autoéchantillonneur munis d'une étiquette et les boucher avec un bouchon pour autoéchantillonneur et un septum garni de téflon.
- Conserver les échantillons à -20 °C pendant au plus 48 heures avant l'analyse.
- Analyse instrumentale : Conditions typiques du CG/SM
- Température de l'injecteur 250 °C.
- Température de la colonne 70 °C pendant deux minutes
3 °C/min jusqu'à 150 °C
20 °C/min jusqu'à 250 °C, maintien pendant trois minutes. - Pression dans la colonne : 12 lb/po2 ou débit constant de 1,0 mL/min.
- Température de la ligne de transfert : 240 °C.
- Température du collecteur : 240 °C.
- Injecter 1 µL de la solution de méthanol, au rythme de 5 µL par seconde, dans le CG/SM en mode « débit non-divisé » (débit divisé de 20 mL/min).
- Mettre le CG/SM en mode pleine échelle (50 à 200 uma). Les pics ci-après sont utilisés pour le dosage :
D5-pyridine 84
D7-quinoléine 136
Pyridine 79
Quinoléine 129
Styrène 104
Nota : Ces masses sont attribuées en tenant compte de la meilleure réponse (c'est-à-dire celle correspondant au pic de base) et de la nécessité d'éviter tout risque de contamination par des pics perturbants correspondant à des ions semblables. Les ions choisis pour le dosage peuvent varier selon la configuration de l'appareil.
Nota : On peut baser le dosage sur la hauteur des pics si les pics perturbants ne peuvent être entièrement résolus (voir les annexes 1b et 1c).
- Courbe d'étalonnage
- Tracer une nouvelle courbe d'étalonnage au début de chaque série d'échantillons ou de chaque « projet ». Injecter chaque solution étalon une seule fois et créer un fichier d'étalonnage en utilisant la méthode de dosage avec étalons internes disponible avec le logiciel de dosage Saturn.
- Analyser un « étalon de référence » à chaque série de 20 échantillons et au moins une fois par série d'analyses. Traiter cet étalon comme un échantillon normal et comparer la valeur obtenue avec la valeur prévue.
- Si les résultats obtenus se situent dans l'intervalle de ± 10 % de la valeur prévue, l'étalonnage de l'appareil est encore valide.
- Si les résultats obtenus diffèrent par plus de 10 % de la valeur prévue, l'étalonnage n'est plus valide et il faut tracer une nouvelle courbe d'étalonnage.
- Exemple de calculs
- Utiliser le logiciel du système CG/SM pour générer des résultats pour chaque analyte en tenant compte de la concentration des solutions étalons. Les résultats sont exprimés en µg/mL. Calculer les résultats finaux à l'aide de l'équation suivante :
Analyte (µg/cigarette) = [Conc. de l'analyte dans l’échantillon (µg/mL) × volume (mL)] / nombre de cigarettes
- Utiliser le logiciel du système CG/SM pour générer des résultats pour chaque analyte en tenant compte de la concentration des solutions étalons. Les résultats sont exprimés en µg/mL. Calculer les résultats finaux à l'aide de l'équation suivante :
15 Contrôle de la qualité
- Chromatogrammes typiques
- Voir les annexes
- Taux de récupération et niveaux de contamination
- Les blancs de réactifs (BR) permettent de déterminer les effets perturbants possibles des réactifs. Analyser un BR pour chaque série de 20 échantillons. Préparation du BR : découper un tampon de 92 mm en quatre et le déposer dans un erlenmeyer en PMP contenant 400 µL de solution étalon ÉI et 40 mL de méthanol. Traiter le BR comme s'il s'agissait d'un échantillon. Normalement, on ne détecte aucun des analytes (résultat = ND).
Nota : Au lieu d'un BR, on peut utiliser un blanc de fumage pour déterminer s'il y a contamination des réactifs et de l'air ambiant dans la chambre de fumage. Pour ce faire, procéder au fumage mécanique sans cigarette, en réglant l'appareil au même nombre de bouffées que celui utilisé pour une cigarette témoin. Normalement, le résultat obtenu avec tel un blanc de fumage se situe entre 0,06 et 0,12 µg/mL (ce qui équivaut à 0,12 - 0,24 µg/cigarette) pour la pyridine et le styrène et ND pour la quinoléine. - On peut analyser un blanc fortifié (BF) pour évaluer l'importance des pertes possibles d'analytes. Découper un tampon de 92 mm en quatre et le déposer dans une fiole contenant 400 µL de solution étalon ÉI, une portion appropriée d'étalon secondaire mixte et 40 mL de méthanol. Traiter le BF comme tout autre échantillon, conformément à la méthode. Le taux de récupération devrait être de presque 100 %.
- On peut analyser une matrice fortifiée (MF) pour évaluer les effets perturbants possibles de la matrice. Préparation de la MF : fumer un échantillon d'une marque témoin et transférer le tampon dans la fiole. Ajouter au tampon de la solution étalon ÉI et une portion d'étalon secondaire mixte. Ajouter également les solutions provenant des impacteurs et traiter cette solution comme s'il s'agissait d'un échantillon. Le taux de récupération devrait être de presque 100 %.
- Les blancs de réactifs (BR) permettent de déterminer les effets perturbants possibles des réactifs. Analyser un BR pour chaque série de 20 échantillons. Préparation du BR : découper un tampon de 92 mm en quatre et le déposer dans un erlenmeyer en PMP contenant 400 µL de solution étalon ÉI et 40 mL de méthanol. Traiter le BR comme s'il s'agissait d'un échantillon. Normalement, on ne détecte aucun des analytes (résultat = ND).
- Limite de détection de la méthode (LDM) et limite de dosage (LDD)
La LDM est égale à la concentration pour laquelle le rapport signal/bruit est de 3/1. La LDD est égale à la concentration pour laquelle le rapport signal/bruit est de 10/1. La LDM devrait être déterminée pour chaque système et elle peut varier d'un instrument à l'autre.
Nota : La présente méthode comprend le dosage des constituants de la fumée de tabac entier qui sont solubles dans le méthanol, sans purification préalable des échantillons. Il faut donc contrôler étroitement les paramètres chromatographiques pour obtenir des pics bien définis et pouvoir bien distinguer les analytes recherchés des autres constituants. - Stabilité des réactifs et des échantillons
- Les étalons primaires sont stables pendant au moins six mois s'ils sont conservés à -20 °C.
- Les solutions étalons sont stables pendant au moins une semaine si elles sont conservées à -20 °C.
- Les flacons ne sont généralement utilisés qu'une seule fois puis jetés car, une fois le septum perforé, il peut y avoir perte de pyridine qui est une substance volatile.
- Les échantillons sont stables pendant au moins une semaine s'ils sont conservés au congélateur et que le septum n'a pas été perforé. Il est essentiel de préparer au moins deux flacons pour chaque échantillon, puisque le flacon est jeté une fois le septum perforé.
16 Modifications pour des conditions intenses de fumage
- Dans des conditions intenses de fumage, fumer 10 cigarettes plutôt que 20.
17 Références
- White, E., Uhrig, M., Johnson, T., Gordon, B., Hicks, R., Borgerding, M., Coleman, W. et Elder, J. Quantitative Determination of Selected Compounds in a Kentucky 1R4F Reference Cigarette Smoke by Multidimensional Gas Chromatography and Selected Ion Monitoring - Mass Spectrometry, Journal of Chromatographic Science, 26, 1990, p. 393-399.
Annexes
Annexe 1a : Chromatogramme typique
Chromatogramme Plot
Commentaire: SUPELCOWAX 30X0. 25X0. 25 1ZPSI 70CSTART INJ250C FASTINJ (5)
Nombre de balayages: 1000
Temps de rétention: 30:00
Intervalle/masse: 50 - 200
Tracé : 1 à 1000
Intervalle : 1 à 1800
Cette figure est un chromatogramme typique.
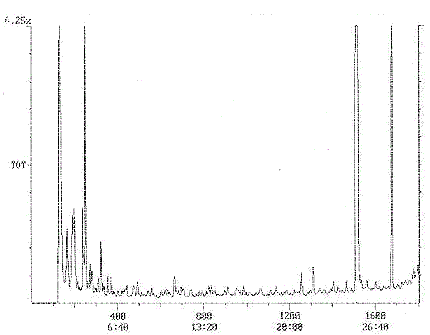
Annexe 1b : Chromatogramme typique - Pyridine
Chromatogramme Plot
Commentaire: SUPELCOWAX 30X0. 25X0. 25 1ZPSI 70CSTART INJ250C FASTINJ (5)
Nombre de balayages: 400
Temps de rétention: 6:40
Intervalle/masse: 50 - 200
Tracé : 100 à 400
Intervalle : 1 à 1800
Cette figure est un chromatogramme typique de pyridine.
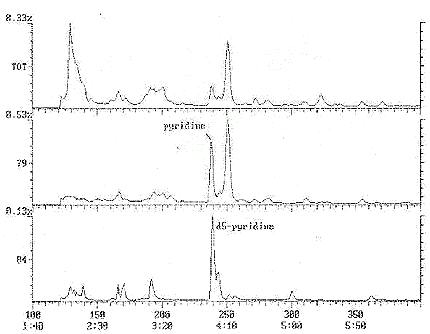
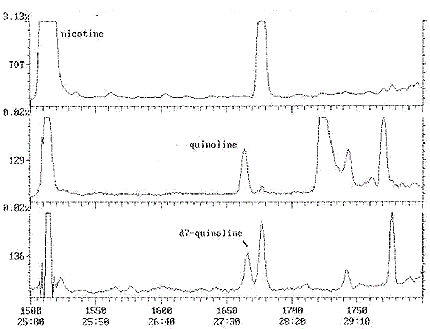
Annexe 1c : Chromatogramme typique - Quinoléine
Chromatogramme Plot
Commentaire: SUPELCOWAX 30X0. 25X0. 25 1ZPSI 70CSTART INJ250C FASTINJ (5)
Nombre de balayages: 1800
Temps de rétention: 30:00
Intervalle/masse: 50 - 200
Tracé : 1500 à 1800
Intervalle : 1 à 1800
Cette figure est un chromatogramme typique de quinoléine.
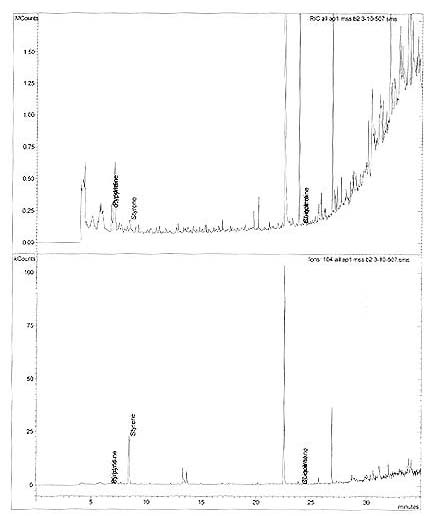
Annexe 1d : Chromatogramme typique - Styrène
Chromatogrammes
Échantillon: AP1 MSS B2 3-10-507
Intervalle de balayage: 1 - 2099
Intervalle de temps: 0.00 - 34.97
Cette figure est un chromatogramme typique de styrène. Les pics de la pyridine et de la quinoléine sont aussi étiquetés.