Dosage du propionate de sodium dans le tabac entier
Santé Canada
T-312 31 décembre 1999
Table des matières
- Portée des applications
- Méthodes applicables
- Définitions
- Résumé de la méthode
- Appareillage et équipement
- Réactifs et matériel
- Préparation de la verrerie
- Préparation des solutions
- Préparation des étalons
- Échantillonnage
- Analyse
- Contrôle de la qualité
- Références
- Annexe
1 Portée des applications
- Cette méthode décrit l'extraction du propionate de sodium propionate du tabac entier et son dosage par CPG avec une colonne capillaire et un détecteur à ionisation de flamme.
- La présente méthode n'est utilisée que pour le dosage du propionate de sodium ajouté au tabac comme antimoisissures ou fongicide. Elle est conçue pour l'analyse de routine, sans la nécessité de préparer un dérivé.
- Elle ne permet pas de distinguer entre la quantité de propionate de sodium ajoutée au tabac entier et la quantité d'acide propionique d'origine naturelle (le cas échéant). Elle ne permet pas de distinguer entre le propionate de sodium et l'acide propionique, qui peut être le produit de certaines formes de fermentation anaérobie.
- Cette méthode est destinée à servir au dosage non pas de traces, mais plutôt du propionate de sodium en tant qu'additif dont la concentration est de l'ordre de 0,4 %.
2 Méthodes applicables
- Méthode d'essai de Santé Canada T-115 - Dosage du goudron, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 1999-12-31.
- American Society for Testing and Materials (ASTM) : Méthode D 1193-77 - Standard Specification for Reagent Water, Version 1977.
- Méthode d'essai de Santé Canada T-402 - Préparation des cigarettes, du tabac à cigarettes, des cigares, des kreteks, des bidis, du tabac en feuille, du tabac à pipe et du tabac sans fumée aux fins d'essais, 1999-12-31.
3 Définitions
- Voir la définition des termes utilisés dans le présent document dans la publication T-115.
4 Résumé de la méthode
- Du tabac entier est soumis à une extraction avec une solution aqueuse à 20 % de H2SO4 0,01 N dans le méthanol, dans des conditions extrêmement douces.
- Du chlorure de calcium (CaCl2) est utilisé pour saturer la solution en espèces ioniques (l'équilibre entre l'ion propionate et l'acide libre est déplacé vers l'acide libre en raison de la faible valeur de son Ka, soit 1,34 × 10-5.
- L'acide isobutyrique (Ka = 1,44 × 10-5) est utilisé comme étalon interne (il a aussi pour effet de réduire au minimum les différences potentielles de pH entre les échantillons et les étalons, ce qui pourrait influer sur le rapport ion/acide libre).
- L'acide libre est ensuite dosé en chromatographie en phase gazeuse, par injection, sans division de débit, de la solution méthanolique sur une colonne capillaire garnie de silice fondue Stabilwax-DA (ou l'équivalent), et dosage à l'aide d'un détecteur à ionisation de flamme (DIF).
- Le dosage est réalisé par étalonnage interne, en comparant la réponse de l'échantillon à une courbe d'étalonnage en cinq points du même acide au même type de dilution.
Nota : L'analyse et l'évaluation de certains produits à l'aide de cette méthode peuvent nécessiter l'utilisation de substances ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode normalisée, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte des règlements en vigueur.
5 Appareillage et équipement
- Erlenmeyers de 125 mL, en polyméthylpentène (PMP), avec col à vis.
- Fiole jaugée de 2000 mL.
- Fiole jaugée de 100 mL.
- Éprouvette graduée de 100 mL.
- Tubes à culture de 16 × 125 mm avec col à vis et bouchons (sans revêtement).
- Finnpipette, 0 - 5 mL ou l'équivalent.
- Micropipettes pour la préparation des étalons analytiques.
- Dispensette, 10 - 50 mL.
- Micropipette de 200 µL.
- Micropipette de 25 µL.
- Chromatographe en phase gazeuse comprenant :
- Injecteur sans division de débit.
- Échantillonneur automatique.
- Détecteur à ionisation de flamme.
- Système de collecte des données.
- Flacons pour échantillonneur automatique, avec bouchon et septum recouverts de téflon.
- Colonne Stabilwax-DA de 30 m × 0,32 mm × 1,0 µm (revêtement mixte Carbowax - PEG, pour les composés acides) ou Nukol de 30 m × 0,32 mm × 0,25 µm, ou l'équivalent.
- Centrifugeuse.
- Agitateur magnétique.
- Lyophilisateur.
- Agitateur oscillant.
6 Réactifs et matériel
Nota : Tous les réactifs doivent être au moins de qualité analytique.
- Propionate de sodium (NaProp).
- Acide isobutyrique.
- Acide sulfurique (H2SO4) à 95 - 97 %.
- Eau de type I - conformément aux spécifications de la norme D1193 de l'ASTM.
- Méthanol.
- Chlorure de calcium (CaCl2).
- Réactifs facultatifs (pour le dosage éventuel d'autres acides organiques) :
- Acide n-butyrique.
- Acétate de sodium.
- Parafilm® ou l'équivalent.
7 Préparation de la verrerie
- La verrerie doit être lavée et séchée de façon à s'assurer qu'elle ne causera aucune contamination.
8 Préparation des solutions
- Solution d'extraction du tabac (composant aqueux)
- Mettre 35 g de CaCl2 dans une fiole jaugée de 2000 mL.
- Ajouter environ 1 L d'eau de type I et mélanger jusqu'à ce que tout le CaCl2 soit dissous.
- Rincer le col de la fiole pour faire passer en solution le CaCl2 qui pourrait s'y trouver. Si un précipité blanc se forme, refaire la solution, en prenant soin de mieux rincer le col de la fiole avec de l'eau de type I.
- Ajouter 0,54 mL de H2SO4 concentré.
- Remplir au trait avec de l'eau de type I.
- 0,01 N H2SO4
- Ajouter 0,27 mL de H2SO4 concentré à environ 700 mL d'eau de type I dans une fiole jaugée de 1 L.
- Remplir au trait avec de l'eau de type I.
9 Préparation des étalons
- Étalon primaire de propionate de sodium (concentration finale : environ 20 mg/mL)
- Peser exactement 2 g de propionate de sodium dans une fiole jaugée de 100 mL.
- Remplir au trait avec du H2SO4 0,01 N.
- Étalon d'acide isobutyrique - ISTD (concentration finale : environ 100 mg/mL)
- Peser avec précision 2,5 g d'acide isobutyrique dans une fiole jaugée de 25 mL.
- Remplir au trait avec du H2SO4 0,01 N.
- Étalons dilués
- Tous les étalons sont préparés par dilution avec du méthanol dans des fioles jaugées de 25 mL.
- On tente de maintenir la proportion d'eau à 10 % dans chacun des étalons en ajoutant la quantité appropriée de composant aqueux pour l'extraction (à 0,05 mL près). Ceci est nécessaire pour maintenir constant le rapport phase organique/ phase aqueuse entre les échantillons et les étalons.
Ce tableau présente les caractéristiques des étalons 0 (blanc) et 1 à 5. Il indique le volume de l’étalon primaire de sodium, l’étalon interne ajouté, la solution d’extraction de chaque étalon, ainsi que la teneur de chaque étalon en propionate de sodium.
Étalon Volume (µL)
d'étalon
primaire de
propionate
de NaVolume (µL)
d'étalon
interne (ISTD),
acide
isobutyriqueVolume
(mL) de
solution
aqueuse
d'extractionPropionate
de Na
(µg/mL)Blanc 0 0 25 2,50 0 Étalon 1 20 25 2,50 16 Étalon 2 50 25 2,45 40 Étalon 3 125 25 2,40 100 Étalon 4 200 25 2,30 160 Étalon5 300 25 2,20 240
Nota 1 : La concentration de propionate de sodium est fonction de la concentration exacte de la solution mère préparée.
Nota 2 : La concentration d'étalon interne est d'environ 100 µg/mL (encore une fois dépendant de la concentration exacte de la solution mère primaire).
10 Échantillonnage
- L'échantillonnage des produits du tabac aux fins des essais doit se faire conformément aux instructions données dans la publication T-115
11 Analyse
- Extraction de tabac entier
- Peser exactement 10 g de tabac « tel que reçu » dans un erlenmeyer en PMP de 125 mL.
- Ajouter 20 mL de composant aqueux pour extraction.
- Ajouter 200 µL de solution mère d'acide isobutyrique, comme étalon interne (en utilisant une micropipette).
- Imbiber le tabac en remuant le flacon, jusqu'à ce que toute la solution soit absorbée ou que le tabac semble saturé.
- Ajouter 80 mL de méthanol à chacun des échantillons.
- Boucher le flacon (le sceller avec du Parafilm® au besoin) et l'agiter sur l'agitateur oscillant pendant 30 minutes.
- Laisser l'échantillon reposer au moins une heure après l'agitation.
- Après quoi, agiter de nouveau l'échantillon pendant 30 secondes.
- Décanter le liquide dans un tube à culture de 16 × 25 mm, à col à vis, et boucher le tube pour éviter toute évaporation.
- Nettoyage des échantillons
- Laisser le précipité déposer au fond du tube à culture, en le laissant reposer pendant deux heures ou : centrifuger à faible vitesse afin de laisser déposer le précipité.
- Transvaser 2 mL de surnageant dans un deuxième tube à culture de 16 × 25 mm, à col à vis.
- Y ajouter 2 mL de méthanol et boucher le tube.
- Mélanger sur agitateur magnétique, pendant 10 secondes à haute vitesse.
Nota : Le reste de surnageant doit aussi être agité et conservé au réfrigérateur au cas où il serait nécessaire de refaire l'analyse de cet échantillon. - Centrifuger l'échantillon dilué, à vitesse moyenne, pour précipiter tout sel qui aurait pu se former lors de l'étape de dilution.
- Transvaser le surnageant dans un flacon à échantilloneur automatique pour chromatographie en phase gazeuse.
- Configuration du chromatographe en phase gazeuse
- Injecteur : Sans division de débit, avec délai de purge de 0,10 minute.
- Tube d'insertion désactivé.
- Détecteur : Ionisation de flamme (DIF).
- Gaz vecteur : He, 12,0 lb/po2, débit = 2,3 mL/minute à 70 °C.
- Division (débit de purge) = 20 mL/minute.
Nota : Régler les débits de gaz pour le détecteur conformément aux spécifications du fabricant.
Nota : La colonne Stabilwax-DA est spécifiquement désactivée de manière à ne pas réagir avec les composés acides. Cela permet le dosage de l'acide libre avec une traînée minimale due à la réactivité de la colonne.
Nota : Le pic dû au méthanol laisse une traînée énorme. Cet effet est minimalisé si le délai de purge (temps de relais) est très court et si la température de l'injecteur est relativement basse. Idéalement, l'injection avec division de débit élimine cette traînée, cependant, elle a pour conséquence de fortement réduire la sensibilité de la méthode.
- Conditions pour la chromatographie en phase gazeuse
- Injecteur : 225 °C.
- Détecteur : 230 °C.
- Profil de température pour la colonne :
Température initiale : 70 °C maintenir deux minutes.
Programmation : 7,5 °C/minute jusqu'à 155 °C minutes; maintenir 2,67
Programmation : 7,5 °C/minute jusqu'à 205 oC minutes; maintenir 4,0
Durée totale de l'analyse : 25,00 minutes.
La programmation de la température de la colonne peut nécessiter de légers ajustements en fonction de la condition de la colonne.
- Conditions pour l'échantillonneur automatique : volume injecté : 1,0 µL
- Calculs
- Tous les calculs sont faits au moyen du facteur de réponse trouvé, pour un étalon interne, par mesure de l'aire sous le pic en fonction de sa concentration.
- Ces facteurs de réponse étalonnés servent à calculer la teneur, exprimée en µg/mL, de chaque analyte présent dans l'échantillon. En introduisant le multiplicateur (volume total, en mL) et le diviseur (poids de l'échantillon d'origine, en g) appropriés, la teneur en propionate de sodium est calculée.
- Pour convertir cette teneur en pourcentage (%), il faut diviser le résultat exprimé en µg/g par 10000.
- Tous les résultats sont exprimés en fonction du tabac « tel que reçu ». Ils peuvent l'être en fonction de la matière sèche en tenant compte du degré d'humidité trouvé.
- Les calculs typiques sont les suivants :
- Résultat de l'analyse
NaProp (µg/g) = [Aire sous le pic d’analyte / Aire sous le pic ISTD] × [FR µg/ml] × [Multiplicateur (mL) / Diviseur (g)]
où FR est calculé à partir de la courbe d'étalonnage (en concentration par unité de surface). - Conversion en % (« tel que reçu »)
NaProp (%) « tel que reçu » = Résultat en µg/g / 10 000
- Conversion en fonction de la matière anhydre
NaProp (%) « matière anhydre » = [NaProp (%) « tel que reçu »] / [1- (% eau)]
où le degré d'humidité (%) est déterminé dans l'échantillon utilisé pour le dosage du propionate de sodium.
- Résultat de l'analyse
12 Contrôle de la qualité
- Chromatogramme typique
- Voir la figure 1
- Taux de récupération et niveaux de contamination
- Chaque série d'analyses d'échantillons doit comprendre :
- Un blanc de réactif (BR) pour évaluer l'ampleur des perturbations dues à la verrerie, aux solvants d'extraction, aux filtres et au système d'analyse.
- Un blanc fortifié (BF) pour évaluer l'ampleur de la perte éventuelle d'analyte.
- Une matrice fortifiée (MF) pour évaluer les effets de matrice. Pour ce faire doper un échantillon réel avec une quantité connue et en déterminer le taux de récupération (%).
- Chaque série d'analyses d'échantillons doit comprendre :
- Limite de détection de la méthode (LDM) et limite de dosage (LD)
- Limite de détection de la méthode (LDM)
- La limite de détection de la méthode est déterminée par analyse de l'étalon le moins concentré au moins 10 fois pendant une période de plusieurs jours. La LDM est égale à trois fois l'écart-type de ces mesures.
- Limite de dosage (LD)
- La limite de dosage est déterminée par analysant de l'étalon le moins concentré au moins 10 fois pendant une période de plusieurs jours. La LD est égale à 10 fois l'écart-type de ces mesures.
- Limite de détection de la méthode (LDM)
- Stabilité des réactifs et des solutions
- De nouveaux étalons primaires de propionate de sodium sont préparés chaque semaine.
- De nouveaux étalons dilués et de nouvelles solutions d'extraction sont préparés chaque semaine.
- Tous les échantillons sont analysés aussi tôt que possible et dans les 24 heures.
13 Références
- Méthode officielle 971.11 de l'AOAC, « Fatty Acids (Volatile) in Eggs, Gas Chromatographic Method», AOAC Official Methods of Analysis (1995), ch. 34, p. 10-12.
- CRC Handbook of Chemistry and Physics, 58e édition, CRC Press Inc., 1977- 1978, p. D-150, D-151.
- Determination of Sorbic Acid in Tobacco, RJR Macdonald R & D, p. 56-60.
- Organic Chemistry, 2e édition, Fessenden et Fessenden, Willard Grant Press, 1979, p. 588, 627, 628.
- The Merck Index, An Encyclopedia of Chemicals and Drugs, 8e édition, Merck & Co Inc., 1968.
14 Annexe
Figure 1 : Exemple de chromatogramme obtenu avec l'étalon le plus concentré en acides organiques. Les pics sont élués dans l'ordre suivant : acide acétique, acide propionique, acide isobutyrique et acide n-butyrique.
Cette figure est un exemple de chromatogramme de l’étalon ayant la plus forte teneur en acides organiques. L’ordre d’élution est le suivant : acide acétique, acide propionique, acide isobutyrique et acide n-butyrique.
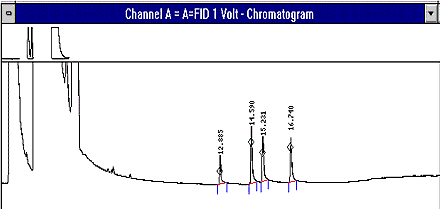
Titre : Acide propionique sur Stabilwax-DA de 30 m × 0,32 mm × 1 µm
Fichier analyse : C:\STAR\MODULE16\PROP373.RUN
Fichier méthode : C:\STAR\PROP4.MTH
No d'échantillon : Étalon no 5.