Essai de fixation du colorant rouge neutre avec de la fumée principale de tabac
Santé Canada
T-502
Deuxième édition
01 novembre 2004
Table des matières
- Portée
- Méthodes applicables
- Définitions et abréviations
- Résumé de la méthode
- Appareillage et équipement
- Réactifs et matériel
- Préparation de la verrerie et du matériel en plastique
- Préparation des solutions et des milieux
- Cultures de la suspension de culture de cellules de CHO
- Collecte des phases particulaire et gazeuse de la fumée
- Préparation des échantillons (PP; PG; PP+PG)
- Essai de cytotoxicité
- Calcul de l’absorbance relative
- Contrôle de la qualité et documentation
- Communication des résultats de l’essai
- Références
- Annexes
1 Portée
- Applicable à l’évaluation du potentiel cytotoxique de la fumée de cigarette par l’essai de fixation du colorant rouge neutre. La méthode comprend la préparation de cellules ovariennes de hamster nain de Chine (CHO), le traitement avec différentes fractions de fumée de cigarette, la fixation du colorant rouge neutre par des cellules CHO traitées et non traitées et l’analyse des résultats.
- La méthode s’applique à :
- la phase particulaire (PP) de la fumée de cigarette
- la phase gazeuse (PG) de la fumée de cigarette
- la combinaison de la phase particulaire et de la phase gazeuse (PP+PG)
2 Méthodes applicables
- Méthode officielle T-115 de Santé Canada. Dosage du goudron, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac. Deuxième édition. 2003. (Dispositions relatives aux cigarettes fabriquées seulement)
- Organisation internationale de normalisation. Méthode ISO 3308 Cigarettes - Machine à fumer analytique de routine pour cigarettes – Définitions et conditions normalisées. 2000.
- Organisation internationale de normalisation. Méthode ISO 4387 Cigarettes – Déterminations de la matière particulaire totale et de la matière anhydre et exempte de nicotine au moyen d’une machine à fumer analytique de routine. 2000.
- US National Institutes of Health. NIH Publication No: 01-4500: Guidance Document on Using In Vitro Data to Estimate In Vivo Starting Doses for Acute Toxicity. 2001. (« Appendix C » seul).
3 Définitions et abréviations
- Cellules CHO : Cellules ovariennes de hamster nain de Chine.
- CI50 : Concentration qui réduit de 50 % l’activité au sein d’une population cellulaire. Cette réduction est mesurée par l’absorbance du colorant rouge neutre.
- CMF-PBS : Solution saline tamponnée au phosphate sans chlorure de calcium ni chlorure de magnésium.
- Cytotoxicité : Atteinte, mort ou altération de la croissance au sein d’une population cellulaire causée par des substances toxiques.
- Disque (tampon) filtrant en fibre de verre : Tampon utilisé pour recueillir la matière particulaire de la fumée de tabac
- DMSO : Diméthylsulfoxyde.
- Hématimètre : Surface quadrillée servant à compter le nombre de cellules en suspension.
- PP : Phase particulaire de la fumée de tabac.
- PG : Phase gazeuse de la fumée de tabac.
- PP+PG : Combinaison 1:1 (v/v) de la phase particulaire et de la phase gazeuse.
- Rouge neutre : Colorant qui diffuse dans les cellules viables et s’accumule dans les lysosomes où il se fixe à des sites anioniques.
- Sous-échantillon : Mélange de MPT préparé à partir d’un groupe de cigarettes fumées en même temps, provenant du même échantillon de cigarettes.
4 Résumé de la méthode
- Des cigarettes (p. ex. 20 cigarettes) sont fumées sur une machine à fumer rotative à 20 canaux selon les conditions ISO modifiées (intenses).
- La fumée principale passe à travers un tampon-filtre de 92 mm pour la collecte de la PP, et passe ensuite dans un piège contenant du CMF-PBS pour la collecte de la PG.
- Les deux fractions, qu'elles soient dans du DMSO (PP) ou dans une solution saline tamponnée au phosphate (PG), sont préparées à une concentration 10 mg PP/mL de solution (ou l'équivalent de 10 mg de PP/mL de solution dans le cas de la PG).
- Des cellules CHO sont mises
en présence de l’échantillon d’essai dans une plaque de culture de tissus moins
de 1 heure après le fumage, à cause de l’instabilité de l’extrait de la PG.
Après le traitement, l’échantillon d’essai est retiré et la culture est exposée
à une solution de rouge neutre.
Nota : Un blanc et des témoins négatif (solvant) et positif sont mis à l’essai en même temps. - Les cellules sont lavées et fixées, puis le colorant rouge neutre est extrait au moyen d’une solution renfermant de l’acide acétique glacial et de l’éthanol.
- On mesure l’absorbance à 540 nm pour chaque culture.
- On calcule les moyennes et les écarts types d’absorbance de 8 puits de la plaque de microtitrage pour chaque concentration de l’échantillon. La cytotoxicité est indiquée par une baisse de la capacité de fixation du colorant rouge neutre par les lysosomes des cellules altérées. Pour calculer la cytotoxicité, on divise l’absorbance des cellules traitées à 540 nm par l’absorbance des cellules témoins négatives à 540 nm, et on multiplie par 100.
- Le nombre de sous-échantillons est celui stipulé dans la réglementation applicable.
Mise en garde : L’analyse et l’évaluation de certains produits à l’aide de cette méthode d’essai peuvent exiger l’utilisation de matériel et/ou d’équipement potentiellement dangereux. Le présent document ne prétend pas couvrir tous les aspects de sécurité liés à l’utilisation de ce test. Il incombe à l’utilisateur de consulter les autorités compétentes et de déterminer au préalable les pratiques adéquates de santé et sécurité, conformément aux exigences réglementaires applicables.
5 Appareillage et équipement
- L’équipement nécessaire pour la collecte de la PP et de la PV est indiqué à l’annexe 1.
- Tout l’appareillage et l’équipement nécessaires pour effectuer le test de fixation du rouge neutre. Voir la publication n° 01-4500 (2001) du NIH.
- Microscope inversé (ou l‘équivalent)
- Lecteur de microplaques (longueur d’onde : 540 nm) [p. ex. Bio-Tek Instruments Inc. Universal Microplate Reader, model Elx800 ou l’équivalent].
6 Réactifs et matériel
Nota : Dans la mesure du possible, on a identifié les réactifs par leur numéro du registre du Chemical Abstract Service [CAS] entre crochets. Tous les réactifs doivent être, si possible, de qualité analytique.
- Les réactifs et matériels
utilisés doivent être ceux mentionnés dans la publication n° 01-4500 (2001) du
NIH (avec les ajouts suivants) :
- Cellules CHO dans un milieu de croissance
- Solution rouge neutre
- Sérum de veau fœtal
- Mélange nutritif Ham F12 avec L-glutamine et NaHCO3
- Solution saline tamponnée au phosphate sans calcium ni magnésium (CMF-PBS)
- Solution de pénicilline-streptomycine
- Solution de bleu trypan (0,4%)
- Trypsine [9002-07-7 ou l’équivalent]
- Formaldéhyde
- Sodium lauryl sulphate (SLS) [151-21-3]
- Ethanol (dénaturé, 2A) [64-17-5]
- Filtre stérile 0.2 µm
- Eau désionisée stérile
- Réactifs et matériel pour la collecte et la préparation des échantillons, conformément à l’annexe 1
7 Préparation de la verrerie et du matériel en plastique
- La verrerie et le matériel en plastique doivent être stériles, propres et, si nécessaire, jetables.
- Le nettoyage requis pour la collecte et la préparation des échantillons d’essai est indiqué à l’annexe 1.
8 Préparation des solutions et des milieux
Nota : Préparer tous les réactifs et les milieux en appliquant les techniques d’asepsie standard et, s’il y a lieu, les directives du fabricant concernant la préparation des solutions.
Nota : Préparer les produits qui pourraient être cancérogènes ou toxiques sous une hotte en prenant les précautions nécessaires pour ce type de produit dangereux.
- Préparer le milieu de
croissance complet en mélangeant 90 % de mélange nutritif avec 10 % de sérum de
veau fœtal, 100 unités/mL de pénicilline et 100 µg/mL de streptomycine.
Nota : Le milieu de croissance est utilisé comme diluant et comme blanc d’essai dans cette épreuve. - Préparer la CMF-PBS selon les directives du fabricant.
- Préparer une solution de trypsine 0,25 % (p/v) dans la CMF-PBS la veille de l’épreuve.
- Préparer une solution de
colorant rouge neutre (sans cristaux) à 50 µg/mL dans le mélange nutritif, la journée
précédant son utilisation. Mettre la solution, fermée légèrement, dans un
incubateur CO2 toute une nuit, à 37°C ± 1°C
et sous une atmosphère humidifiée de 5% de CO2. La journée de
l’utilisation, retirer les cristaux de la solution par filtration à travers des
filtres à pores de 0.2 µm
jetables et stériles.
Nota : On peut également préparer une solution de colorant rouge neutre à 50 mg/mL (sans cristaux) dans le mélange nutritif F-12 Ham avec L-glutamine conformément à la publication no 01-4500 (2001) du NIH. - Le jour même, préparer une solution de formaldéhyde à 1 % dans de l’eau désionisée stérile.
- Préparer le jour même une solution pour l’extraction du colorant rouge neutre renfermant 50 % (v/v)d’éthanol, 1 % (v/v) d’acide acétique glacial et49 % (v/v) d’eau désionisée stérile.
-
Préparation des solutions témoins négatives
- Préparer une solution à 2%
(v/v) de chacun des solvants suivants dans le milieu de croissance à titre de
témoins négatifs :
- DMSO
- CMF-PBS
- DMSO/CMF-PBS (1:1)
- Préparer une solution à 2%
(v/v) de chacun des solvants suivants dans le milieu de croissance à titre de
témoins négatifs :
-
Préparation des solutions témoins positives
- Préparer une solution mère de SLS dans de l’eau désionisée stérile (p. ex. 20 mg de SLS/mL).
- Au début d’une épreuve,
préparer 2 concentrations appropriées de SSL dans le milieu de croissance.
Nota : L’une des solutions est jugée létale pour 50 % des cellules (p. ex. 110 µg/mL). L’autre solution est jugée létale pour toutes les cellules (p. ex. 200 µg/mL).
9 Cultures de la suspension de culture de cellules de CHO
- Calculer la quantité de suspension de cellules CHO nécessaire pour réaliser l’épreuve. Il faut vingt mL d’une culture de 50 000 cellules viables par mL par plaque de 96 puits. Préparer et utiliser quatre plaques de 96 puits par échantillon (8 puits par concentration par plaque).
- Les cellules CHO sont
habituellement cultivées en monocouche dans des flacons de qualité culture
tissulaire à 37 ± 1 °C dans une atmosphère humidifiée à 5 % de CO2.
Lorsque les cellules tendent à confluer, les repiquer par trypsinisation
en suivant les étapes suivantes :
- Enlever le milieu de croissance.
- Ajouter de la CMF-PBS pour rincer.
- Jeter la solution de rinçage.
- Ajouter encore de la CMF-PBS pour rincer.
- Jeter la solution de rinçage.
- Ajouter une solution de trypsine à 0,25 % à la monocouche pour la période souhaitée, puis la retirer.
- Ajouter du milieu de croissance au flacon et bien mélanger jusqu’à l’obtention d’une suspension de cellules individuelles.
-
Numération
du nombre de cellules CHO dans la suspension de cellules individuelles
- Mélanger 0,5 mL de la suspension de cellules avec 0,5 mL de solution de bleu trypan à 0,4 %. Faire preuve de prudence en travaillant avec le bleu trypan, car il s’agit d’un produit toxique potentiellement carcinogène.
- Laisser reposer le mélange durant au moins 5 minutes, mais pas plus de 15 minutes.
- S’assurer que l’hématimètre est propre et sec avant de l’utiliser. Garder la lamelle en place sur l’hématimètre.
- Déposer la suspension de cellules et de bleu trypan dans la chambre de l’hématimètre avec un tube capillaire ou un autre dispositif approprié. Ne pas trop remplir ni sous-remplir les chambres.
- Compter le nombre de cellules viables et non viables dans 4 carrés des coins et 1 carré central. Les cellules non viables prendront une couleur bleue.
- Calculer le nombre moyen de cellules viables par carré.
- Calculer le nombre de
cellules jetables par mL de suspension cellulaire
comme suit :
Cellules viables/mL = (nombre moyen de cellules/carré) × (facteur de dilution) x 104 (facteur de conversion de la chambre).
Exemple : (125 cellules) × (2) × 104 = 2,5 × 106 cellules/mL. - Après avoir déterminé le nombre de cellules, on peut effectuer une nouvelle culture des cellules en les plaçant dans un autre flacon ou en les ensemençant dans une plaque de microtitrage de 96 puits à une densité de 5 × 104 cellules/mL de milieu de croissance.
10 Collecte des phases particulaire et gazeuse de la fumée
- Consulter l’annexe 1.
11 Préparation des échantillons (PP; PG; PP+PG)
- Consulter l’annexe 1.
12 Essai de cytotoxicité
- Préparation de la plaque de culture de tissus de 96 puits
- Ne pas mettre de cellules CHO dans la première colonne, qui servira de témoin à blanc.
- Mettre 200 µL de suspension de cellules dans chacun des puits restants de la plaque de culture tissulaire.
- Confirmer la présence ou l’absence de cellules CHO à l’aide d’un microscope inversé.
- Incuber la plaque à 37 ± 1 °C dans une atmosphère humidifiée de 5 % de CO2 durant 24 ± 3 heures.
-
Préparation
des concentrations voulues des échantillons et
témoins
- Préparer les concentrations
voulues du témoin négatif, des échantillons de fumée (PP ou PG ou PP+PG) ou du
témoin positif en mélangeant les quantités appropriées de milieu de croissance.
Nota : Si on ne connaît pas la plage de réponse prévue, il faut aussi procéder à une expérience de détermination de la plage conformément à la NIH Publication No: 01- 4500 (2001) pour s’assurer que ces concentrations produisent une inhibition d’environ 10 % à 90 % de la fixation du colorant rouge neutre.
Nota : On a observé que pour les fractions de PP, de PG, et la combinaison PP+PG préparés à partir de tabac jaune “typique” canadien, les concentrations de 0, 10, 50, 75, 100, 120, 140, 160, et 200 µg/mL donnent habituellement une réponse satisfaisante.
Nota : Le solvant utilisé pour préparer des dilutions doit correspondre au solvant utilisé dans la préparation des échantillons d’essai (p. ex. DMSO, CMF-PBS, DMSO/CMF- PBS).
- Préparer les concentrations
voulues du témoin négatif, des échantillons de fumée (PP ou PG ou PP+PG) ou du
témoin positif en mélangeant les quantités appropriées de milieu de croissance.
-
Exposition
des cellules CHO à des fractions de fumée
- Retirer le milieu de culture de chaque puits.
- Traiter les 8 puis de chaque colonne (p. ex. rangées A-H) au moyen du blanc, du témoin négatif, du témoin positif ou de chacune des différentes concentrations de fraction de fumée de tabac.
- Ajouter 200 µL de milieu de croissance renfermant le témoin négatif, le témoin positif ou l’une ou l’autre des différentes concentrations de fraction de fumée de tabac.
- Incuber la plaque de 96 puits préparée à 37 ± 1 oC sous une atmosphère humidifiée de 5 % de CO2 pendant 24 heures.
-
Traitement
des cellules CHO avec le rouge neutre en vue de produire une fixation
cellulaire
- Retirer le milieu des puits après 24 heures d’exposition à l’échantillon à tester.
- Ajouter 200 µL (37 ± 1 °C) de solution CMF-PBS préchauffée.
- Retirer la solution CMF-PBS.
- Ajouter 200 µL de solution de rouge neutre filtrée à chaque puits.
- Incuber les cellules à 37 ± 1 °C durant 3 heures sous une atmosphère humidifiée de 5 % de CO2.
-
Fixation
des cellules CHO après incubation avec le formaldéhyde à 1 %
- Retirer la solution de rouge neutre de la plaque.
- Ajouter 200 mL de solution de formaldéhyde à 1 % fraîchement préparée à chaque puits.
- Retirer la solution de formaldéhyde après 1 (pas plus de 2 minutes après l’addition).
-
Extraction
du rouge neutre des cellules CHO fixées
- Après avoir retiré la solution de formaldéhyde à 1 % des puits, ajouter dans chaque puits 200 mL de solution d’éthanol à 50 % fraîchement préparée contenant 1 % d’acide acétique 1 %.
- Passer la plaque à l’agitateur de plaque à microtitrage durant 5 à 10 minutes.
-
Détermination
de l’absorbance du colorant rouge neutre extrait des cellules CHO
- Mesurer l’absorbance des puits contenant la solution de rouge neutre extraite sur un lecteur de microplaques à une longueur d’onde de 540 nm.
13 Calcul de l’absorbance relative
Nota : Afin de comparer les résultats d’un essai à l’autre, les résultats bruts d’absorbance pour chaque plaque sont corrigés en fonction des blancs, puis normalisés en fonction du témoin négatif avant l’analyse des données.
- Il faut soustraire l’absorbance moyenne de tous les puits de blancs d’essai de l’absorbance non corrigée de chaque témoin négatif, témoin positif et puits de traitement pour obtenir des valeurs d’absorbance corrigées en fonction des blancs.
- Pour calculer l’absorbance relative, diviser l’absorbance de chaque témoin positif et puits de traitement corrigée en fonction des blancs par l’absorbance moyenne des témoins négatifs de la plaque corrigée en fonction des blancs. Exprimer chaque fraction d’absorbance sous forme de pourcentage du témoin négatif pour obtenir l’absorbance relative (%).
14 Contrôle de la qualité et documentation
- Produits chimiques et milieux
- Vérifier et enregistrer la stérilité des milieux, des réactifs et des solutions selon les bonnes pratiques de laboratoire de culture des tissus. Vérifier les caractéristiques de performance des solutions témoins.
-
Entretien des cultures de cellules
- Il faut examiner chaque jour la culture de cellules sous un microscope inversé et noter tout changement de morphologie ou des propriétés d’adhésion.
- Il faut vérifier régulièrement l’absence de contamination par des mycoplasmes (p. ex. au moyen de la trousse de coloration des mycoplasmes de Sigma) et n’utiliser que des cellules exemptes de mycoplasme.
-
Témoins
- Pour évaluer le rendement
global de l’essai, on doit inclure la cigarette Kentucky Reference 2R4F comme
témoin dans l’échantillon. (Les résultats obtenus avec la cigarette témoin
peuvent être comparés, au moyen de techniques statistiques appropriées, aux «
valeurs prévues » établies par le laboratoire. Si le laboratoire n’a pas établi
de valeurs prévues, on peut comparer les résultats obtenus avec la cigarette
témoin aux valeurs relevées dans la documentation scientifique. Ce genre de
comparaison renseigne sur l’exactitude et la précision de l’essai.)
Nota : Les résultats concernant la CI50 pour chaque essai sur une fraction de fumée de cigarette témoin devraient être évalués à l’aide de méthodes appropriées faisant appel à des diagrammes de contrôle. V. Introduction to Statistical Quality Control, John Wiley & Sons, Inc., ISBN 0-471-51988-X. - Chaque plaque de culture de tissus à 96 puits doit contenir une colonne à blanc renfermant du milieu seulement (qui tient compte de l’absorbance du milieu).
- Chaque plaque de culture de tissus doit avoir une colonne témoin (8 rangées) renfermant uniquement du solvant (témoins négatifs).
- Chaque plaque doit comprendre deux colonnes avec différentes concentrations de SSL, à titre de témoins positifs.
- Pour évaluer le rendement
global de l’essai, on doit inclure la cigarette Kentucky Reference 2R4F comme
témoin dans l’échantillon. (Les résultats obtenus avec la cigarette témoin
peuvent être comparés, au moyen de techniques statistiques appropriées, aux «
valeurs prévues » établies par le laboratoire. Si le laboratoire n’a pas établi
de valeurs prévues, on peut comparer les résultats obtenus avec la cigarette
témoin aux valeurs relevées dans la documentation scientifique. Ce genre de
comparaison renseigne sur l’exactitude et la précision de l’essai.)
-
Évaluation des témoins négatifs
- L’absorbance moyenne non
corrigée du témoin négatif de chaque plaque d’essai devrait être supérieure à
l’absorbance minimale prédéfinie (voir le tableau 1 ci-dessous), qui dépend du solvant du milieu.
Le tableau suivant présente les valeurs typiques de l’absorbance minimale. Il indique l’absorbance minimale non corrigée mesurée à 540 nm pour plusieurs fractions de fumée et témoins solvants. Le diméthylsulfoxyde (DMSO) combiné à une fraction de la fumée en phase particulaire a donné une absorbance minimale de 0,3. La solution saline tamponnée au phosphate (PBS) combinée à une phase gazeuse a donné une absorbance minimum of 0.2. Enfin, le DMSO et la solution PBS combinés aux phases particulaire et gazeuse ont donné une absorbance minimale de 0,3.
Tableau 1 : Valeurs typiques des absorbances minimales Fraction de fumée Témoin de solvant Absorbance minimale non corrigée (540 nm) PP DMSO 0,3 PG PBS 0,2 PP+PG DMSO+PBS 0,3
- L’absorbance moyenne non
corrigée du témoin négatif de chaque plaque d’essai devrait être supérieure à
l’absorbance minimale prédéfinie (voir le tableau 1 ci-dessous), qui dépend du solvant du milieu.
-
Évaluation des témoins positifs
- L’absorbance relative moyenne des témoins positifs doit satisfaire aux critères d’acceptation appropriés définis par le laboratoire effectuant l’essai.
15 Communication des résultats de l’essai
- Les résultats de cytotoxicité à communiquer comportent
les éléments suivants, selon l’annexe 2 :
- Codes des échantillons (permettant de retracer la marque)
- Paramètres (machine à fumer, date, nombre de bouffées, nombre de cigarettes fumées, matière particulaire totale, délai)
- Absorbance non corrigée de tous les puits de blanc d’essai, de témoin négatif, de témoin positif et des puits de traitement de chaque plaque d’essai (y inclus les moyenne, écart-type et coefficient de variance)
- Absorbance corrigée pour les blancs de tous les puits de témoin négatif, témoin positif et puits de traitement de chaque plaque d’essai (y inclus les moyenne, écart- type et coefficient de variance)
- Absorbance relative pour tous les puits de témoin positif et puits de traitement de chaque plaque d’essai (y inclus les moyenne, écart-type et coefficient de variance)
- Données pour la PP, la PG, et la combinaison PP+PG
16 Références
- Babich H. et Borenfreund E. (1990) Cytotoxic effects of food additives and pharmaceuticals on cells in culture as determined with the Neutral Red assay. Journal of Pharmaceutical Sciences 79: 592-594.
- Bombick BR, Murli H, Avalos JT, Bombick DW, Morgan WT, Putnam KP and Doolittle DJ. (1997) Chemical and biological studies of a new cigarette that primarily heats tobacco. Part 2. In vitro toxicology of mainstream smoke condensate. Food and Chemical Toxicology 36: 183- 190.
- Bombick DW, Ayres PH, Putnam K, Bombick BR and Doolittle DJ. (1998) Chemical and biological studies of a new cigarette that primarily heats tobacco. Part 3. In vitro toxicity of whole smoke. Food and Chemical Toxicology 36: 191-197.
- Borenfreund E. et Puerner JA. (1985) Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters 24: 119-124.
Annexe 1
Préparation et collecte des échantillons à l’essai en vue de la détermination de la cytotoxicité par l’essai de fixation du colorant rouge neutre
1 Résumé
- Les cigarettes (p. ex. 20 cigarettes) sont fumées selon les conditions ISO modifiées (intenses) sur une machine à fumer rotative à 20 canaux.
- Les éléments de la fumée principale en phase particulaire (PP) sont piégés par un filtre en fibre de verre de 92 mm, tandis que ceux en phase gazeuse (PG) sont acheminés vers un impacteur réfrigéré contenant une solution saline tamponnée au phosphate (PBS).
- Les deux fractions, qu’elles
soient dans du DMSO (PP) ou une solution saline tamponnée au phosphate (PG),
sont préparées à une concentration d’environ 10 mg de MPT/mL de solution (ou
l’équivalent de 10 mg de MPT/mL de solution dans le cas de la PG).
Nota : Le nombre de cigarettes fumées doit faire en sorte que les filtres retiennent toute la MPT et que les limites de MPT définies dans la norme ISO 4387 soient respectées. Il est également possible qu’on doive ajuster le nombre de cigarettes afin d’obtenir au moins 180 mg de MPT par filtre de 92 mm.
2 Appareillage et équipement
- Équipement nécessaire au conditionnement, tel que défini dans la méthode officielle T-115 de Santé Canada
- Équipement nécessaire au marquage de la longueur des mégots, tel que défini dans la méthode officielle T-115 de Santé Canada
- Équipement nécessaire au fumage mécanique des produits du tabac, tel que défini dans la méthode officielle T-115 de Santé Canada
3 Réactifs et matériel
Nota : Dans la mesure du possible, il faut identifier les réactifs par leur numéro du registre du Chemical Abstract Service [CAS] entre crochets. Tous les réactifs doivent être au moins de qualité analytique.
- Diméthylsulfoxyde (DMSO)
- Solution saline tamponnée au phosphate stérile (sans CaCl2 ni MgCl2) (PBS)
- 3.3 Ethanol [67-17-5]
- Pipettes sérologiques stériles (5 mL et 10 mL)
- Impacteur (volume d’environ 70 mL) avec fritté à très grande porosité et manchon en téflon
- Filtre en fibre de verre et porte-filtre
- Bain de glace avec glace
- Pipettes Eppendorf et embouts stériles (tailles variées)
- Tubes coniques stériles (15 mL et 50 mL)
- Étamine stérile
- Papier d’aluminium
- Tubes et raccords (Nalgene qualité alimentaire ou équivalent)
- Polymethylpentene (PMP) Erlenmeyer (125 mL) ou équivalent
4 Préparation de la verrerie
- Laver et sécher la verrerie de manière à ce que celle-ci ne cause pas de contamination.
- Stériliser toute la verrerie de laboratoire nécessaire par autoclavage à 121 °C durant 30 minutes à 15 livres par pouce carré.
5 Échantillonnage
- L’échantillonnage des cigarettes à des fins d’analyse doit être effectué conformément à la méthode officielle T-115 de Santé Canada.
6 Préparation des cigarettes
- Marquer la longueur des mégots de l’essai conformément à la méthode officielle T-115 de Santé Canada.
- Préparer les cigarettes à être fumées conformément à la méthode officielle T-115 de Santé Canada.
- Conditionner les cigarettes conformément à la méthode officielle T-115 de Santé Canada.
7 Préparation des impacteurs
NOTA : Stériliser/désinfecter l’équipement et les surfaces de travail afin de réduire au minimum la contamination naturelle durant les tests.
- Envelopper les articles suivants séparément dans du papier d’aluminium et les autoclaver : base de l’impacteur, tige de l’impacteur avec fritté à très grande porosité et raccords supérieur et latéral.
- Couper le tube en plastique (p. ex. tube en plastique Nalgene de qualité alimentaire) en segments de 12 pouces (30 cm) et de 8 pouces (20 cm).
- Rincer l’intérieur des tubes ainsi que les raccords en plastique avec de l’alcool absolu pour les stériliser, puis les envelopper dans du papier d’aluminium.
- Monter la tubulure (p. ex.
tube en plastique Nalgene de qualité alimentaire) et les raccords en plastique
sur la tige de l’impacteur avec fritté à très grande porosité en utilisant de
l’eau bouillante pour ramollir les tubes, puis tremper dans de l’alcool absolu
avant d’attacher. Voir la figure
1 pour un schéma d’assemblage
de l’impacteur.
Figure 1 : Préparation des impacteurs en vue de la collecte de la phase gazeuse
La figure suivante illustre la préparation d’un impacteur pour la collecte d’une phase gazeuse.

Nota : Ne pas retirer le papier d’aluminium emballant la tige avec fritté et le manchon. Il faut s’assurer que le manchon en téflon ne présente pas de craquelure ni de trou. - Ajouter 15 mL de solution PBS froide dans la base de l’impacteur à l’aide d’une pipette sérologique.
- Retirer doucement le papier d’aluminium emballant la tige avec fritté et le manchon, puis immerger la tige dans la solution PBS.
- Retirer temporairement le papier d’aluminium de la base pour vérifier que le fritté est bel et bien immergé dans la solution PBS. Replacer le papier d’aluminium.
- Placer l’impacteur emballé dans le bain de glace, qui doit contenir des cubes de glace, de l’eau et un thermomètre permettant de vérifier que la température ne dépasse pas 1 ° C.
8 Préparation de la machine à fumer
- Les conditions ambiantes de fumage doivent être conformes à celles décrites dans la méthode officielle T-115 de Santé Canada.
- Éviter tout éclairage ultraviolet dans les pièces où des échantillons sont produits ou analysés.
- Les conditions relatives à
la machine à fumer rotative doivent être conformes à celles décrites dans la
méthode officielle T-115 de Santé Canada avec les notes suivantes :
- Pour réduire la contamination bactérienne, nettoyer toutes les rondelles en néoprène et les joints labyrinthe avec de l’éthanol à 70 %.
- Pour réduire la
contamination bactérienne, nettoyer les parties suivantes de la machine à fumer
avec une solution d’éthanol à 70 % :
- plaque pour cendres
- canaux
- porte-filtres
- circuit de fumée
- toutes les surfaces de travail, y compris l’extérieur des fioles à extraction et des bouchons
- tout autre article (p. ex. gants portés par le technicien) qui pourrait entrer en contact avec l’échantillon ou les surfaces de travail nettoyées
-
Monter le circuit de fumée conformément aux indications de la figure 2.
Figure 2 : Collecte d’échantillons en phase particulaire et en phase gazeuse en vue du test de fixation du rouge neutre
La figure suivante présente la collecte d’échantillons en phase particulaire et en phase gazeuse en vue du test de fixation du rouge neutre.
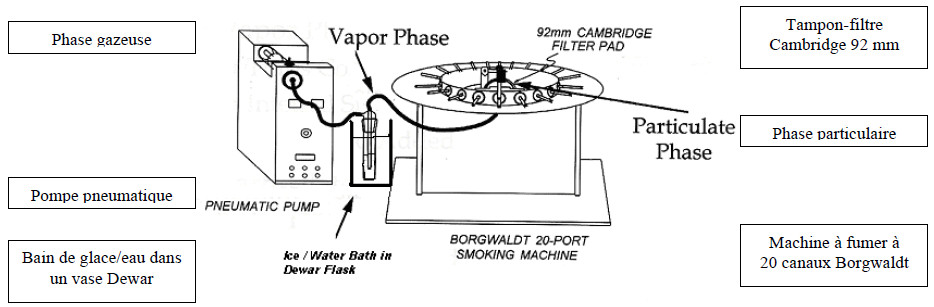
9 Production d’échantillons
- Fumer les cigarettes en
utilisant le circuit de fumée décrit dans la section 8.6 et recueillir la MPT
conformément à la méthode d’analyse T-115 de Santé Canada (avec les
modifications suivantes) :
- Les conditions de fumage
sont modifiées de la façon suivante :
- le volume de chaque bouffée est porté de 35 mL à 55 mL,
- l'intervalle entre chaque bouffée est ramené de 60 s à 30 s,
- tous les orifices de ventilation sont obturés soit par recouvrement du périmètre, de l'embout du filtre à la couture du papier de la manchette, d'une bande adhésive Mylar de marque Scotch (ruban transparent numéro 600) fermement collée, soit selon une autre méthode d'une efficacité équivalente.
- Après le fumage du nombre requis de cigarettes, tirer trois bouffées nettoyantes et retirer le porte-filtre de la machine à fumer.
- Noter l’heure de la fin du fumage ainsi que la durée de la préparation et du traitement des échantillons.
- Noter la température du bain de glace dans lequel se trouve l’impacteur.
- Démonter le circuit de fumée en retirant le porte-filtre de la machine à fumer et fermer l’impacteur en reliant les deux extrémités.
- Les conditions de fumage
sont modifiées de la façon suivante :
- Le nombre de sous-échantillons est celui stipulé dans la réglementation applicable. Tous les sous-échantillons doivent être analysés le même jour.
- Déterminer la matière particulaire totale présente dans la fumée conformément à la méthode officielle T-115 de Santé Canada.
10 Préparation des échantillons
- Phase particulaire
- Après avoir mesuré la MPT, retirer le filtre du porte-filtre, le plier en quatre (le côté exposé à la MPT vers l’intérieur) et frotter le porte-filtre avec le filtre plié.
- Transférer le filtre dans un erlenmeyer stérile en PMP de 125 mL.
- Pipetter la quantité appropriée de DMSO dans l’erlenmeyer de manière que la concentration finale de MPT soit de 10 mg/mL.
- Noter la quantité de DMSO ajouté à l’erlenmeyer.
- Extraire le contenu du filtre dans l’erlenmeyer en PMP durant 20 minutes avec un agitateur oscillant.
- Filtrer cette solution sur une étamine stérile puis l’administrer aux cellules dans l’heure qui suit la production de l’échantillon.
-
Phase gazeuse
- Après avoir mesuré la MPT, ajouter de la solution CMF-PBS froide dans l’impacteur, de manière que le volume total de solution CMF-PBS soit égal à la quantité « réelle » de DMSO utilisée pour extraire la phase particulaire.
- Noter la quantité totale de la solution CMF-PBS ajoutée à l’erlenmeyer afin que la concentration de la PG corresponde à un équivalent de PP de 10 mg/mL de CMF-PBS.
- S’assurer que la solution de CMF- PBS dans l’impacteur est bien mélangée.
- Transférer une quantité suffisante de solution présente dans l’impacteur pour l’analyse dans un tube conique stérile de 50 mL.
- Recouvrir les tubes d’un papier d’aluminium propre.
- Administrer l’échantillon de solution CMF-PBS (préparée conformément à la section 10.2.4) aux cellules dans l’heure qui suit la production de l’échantillon.
-
Combinaison
de phase particulaire et de phase gazeuse
- Pipetter la quantité appropriée de solution présente dans l’impacteur (p. ex. 1,5 mL) dans un tube conique stérile de 15 mL.
- Pipetter une quantité égale (p. ex. 1,5 mL) d’extrait de phase particulaire dans le même tube conique stérile de 15 mL qui contient l’aliquote de solution de CMF-PBS, de manière que la solution combinée contienne des quantités égales de matière particulaire totale (ou d’équivalent de PP) provenant de la phase particulaire et de la phase gazeuse.
- S’assurer que l’échantillon est bien mélangé avant de l’administrer aux cellules.
Annexe 2
Présentation des rapports des échantillons utilisés pour l’essai de la cytotoxicité par la fixation du colorant rouge neutre
1 Codes des échantillons
Le tableau suivant présente une description des échantillons de laboratoire 030001, 030002 et 030003.
| Numéro de l’échantillon du laboratoire | Description de l’échantillon |
|---|---|
| 030001 | Kentucky Reference 2R4F |
| 030002 | Marque X régulière Pleine saveur |
| 030003 | Marque Y King size Moyenne |
2 Données de fumage
Le tableau suivant présente des données sur le fumage issues des essais réalisés sur le groupe 1. Quatre échantillons (030001, 030002, 030003, et 030004) ont chacun été analysés avec 3 sous-échantillons. La date du fumage était le 10 ou le 18 février 2004. Une machine à fumer rotative a été utilisée pour fumer 11, 20 ou 100 cigarettes. Le nombre de bouffées par cigarette allait de 7,1 à 9,6. Le poids de la matière particulaire totale et le décalage ont été notés.
| Groupe | Essai | Échant. | Fraction de fumée | Sous-échantillon | Date de fumage | Cigarettes fumées | Bouffées (par cig.) | Poids de la MPT (mg)1 |
Machine à fumer | Délai2 |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1 | 030001 | A | 1 | 10 février 2004 | 20 | 9,6 | 218 | Borgwaldt rotative | 00:59 |
| 2 | 1 | 030001 | B | 1 | 18 février 2004 | 20 | 9,2 | 243 | Borgwaldt rotative | 00:19 |
| 2 | 1 | 030001 | C | 1 | 18 février 2004 | 20 | 9,2 | 243 | Borgwaldt rotative | 00:46 |
| 1 | 3 | 030002 | A | 1 | 10 février 2004 | 100 | 7,1 | 203 | Borgwaldt rotative | 00:51 |
| 1 | 3 | 030002 | B | 1 | 10 février 2004 | 100 | 7,1 | 203 | Borgwaldt rotative | 00:19 |
| 1 | 3 | 030002 | C | 1 | 10 février 2004 | 100 | 7,1 | 203 | Borgwaldt rotative | 00:39 |
| 2 | 2 | 030003 | A | 1 | 18 février 2004 | 11 | 7,5 | 219 | Borgwaldt rotative | 00:54 |
| 1 | 2 | 030003 | B | 1 | 10 février 2004 | 11 | 7,6 | 215 | Borgwaldt rotative | 00:17 |
| 2 | 2 | 030003 | C | 1 | 18 février 2004 | 11 | 7,5 | 219 | Borgwaldt rotative | 00:47 |
Nota : Les codes suivants sont utilisés pour indiquer la fraction de la fumée principale utilisée
A - Particules (DMSO), B - Phase gazeuse (PBS), C - A + B (DMSO + PBS)
- Échantillons extraits dans le témoin de solvant approprié de façon à obtenir une concentration finale de 10,0 mg/mL.
- Temps écoulé entre la fin du fumage et le début du test (en heures).
3 Données d’absorbance non corrigées
Le tableau suivant présente les valeurs d’absorbance non corrigées issues des résultats du test de fixation du rouge neutre visant à mesurer la cytotoxicité. Il indique les valeurs d’absorbance brutes obtenues sur plaque pour chaque échantillon. Les propriétés des échantillons figurant dans le tableau sont les suivantes : code d’échantillon, fraction de la fumée, numéro de sous-échantillon, numéro de plaque et numéro de puits. Les résultats du blanc d’essai et du témoin sont aussi présentés, de même que les valeurs d’absorbance associées à plusieurs concentrations de condensat de fumée de cigarette (allant de 10 à 200 ug/mL) et de laurylsulfate de sodium (allant de 110 à 200 ug/mL).
| Groupe/essai | Échant. | Fraction de fumée | Sous-échantillon. | Plaque | Puits | Lectures d’absorbance non corrigées | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Blanc d’essai | Témoin* | Matière particulaire totale (µg/mL) | SLS (µg/mL) | ||||||||||||||
| 10 | 50 | 75 | 100 | 120 | 140 | 160 | 200 | 110 | 200 | ||||||||
| 1-1 | 030001 | A | 1 | 1 | 1 | 0,082 | 0,479 | 0,495 | 0,424 | 0,316 | 0,204 | 0,136 | 0,118 | 0,101 | 0,09 | 0,139 | 0,085 |
| 1-1 | 030001 | A | 1 | 1 | 2 | 0,085 | 0,505 | 0,523 | 0,402 | 0,353 | 0,207 | 0,147 | 0,123 | 0,105 | 0,093 | 0,116 | 0,086 |
| 1-1 | 030001 | A | 1 | 1 | 3 | 0,084 | 0,508 | 0,488 | 0,401 | 0,32 | 0,23 | 0,116 | 0,113 | 0,096 | 0,086 | 0,109 | 0,083 |
| 1-1 | 030001 | A | 1 | 1 | 4 | 0,082 | 0,471 | 0,473 | 0,418 | 0,24 | 0,211 | 0,114 | 0,104 | 0,096 | 0,086 | 0,104 | 0,084 |
| 1-1 | 030001 | A | 1 | 1 | 5 | 0,083 | 0,507 | 0,538 | 0,404 | 0,348 | 0,218 | 0,119 | 0,107 | 0,094 | 0,088 | 0,125 | 0,085 |
| 1-1 | 030001 | A | 1 | 1 | 6 | 0,084 | 0,499 | 0,48 | 0,396 | 0,28 | 0,193 | 0,115 | 0,1 | 0,094 | 0,089 | 0,116 | 0,103 |
| 1-1 | 030001 | A | 1 | 1 | 7 | 0,082 | 0,505 | 0,514 | 0,403 | 0,322 | 0,199 | 0,116 | 0,102 | 0,09 | 0,085 | 0,118 | 0,09 |
| 1-1 | 030001 | A | 1 | 1 | 8 | 0,08 | 0,477 | 0,474 | 0,387 | 0,277 | 0,183 | 0,118 | 0,098 | 0,097 | 0,084 | 0,129 | 0,086 |
| Moyenne | 0,083 | 0,494 | 0,498 | 0,404 | 0,307 | 0,206 | 0,123 | 0,108 | 0,097 | 0,088 | 0,120 | 0,088 | |||||
| É.-T | 0,002 | 0,015 | 0,024 | 0,012 | 0,039 | 0,015 | 0,012 | 0,009 | 0,005 | 0,003 | 0,011 | 0,006 | |||||
| Coeff. Var. | 1,9 | 3,1 | 4,9 | 2,9 | 12,5 | 7,1 | 9,9 | 8,3 | 4,8 | 3,4 | 9,4 | 7,4 | |||||
| 1-1 | 030001 | A | 1 | 2 | 1 | 0,08 | 0,482 | 0,47 | 0,389 | 0,314 | 0,227 | 0,13 | 0,117 | 0,102 | 0,089 | 0,103 | 0,085 |
| 1-1 | 030001 | A | 1 | 2 | 2 | 0,08 | 0,498 | 0,506 | 0,394 | 0,303 | 0,227 | 0,13 | 0,113 | 0,104 | 0,096 | 0,103 | 0,085 |
| 1-1 | 030001 | A | 1 | 2 | 3 | 0,082 | 0,494 | 0,527 | 0,41 | 0,31 | 0,191 | 0,123 | 0,106 | 0,096 | 0,088 | 0,11 | 0,084 |
| 1-1 | 030001 | A | 1 | 2 | 4 | 0,081 | 0,513 | 0,512 | 0,415 | 0,311 | 0,205 | 0,118 | 0,097 | 0,096 | 0,087 | 0,107 | 0,084 |
| 1-1 | 030001 | A | 1 | 2 | 5 | 0,081 | 0,505 | 0,503 | 0,396 | 0,306 | 0,192 | 0,101 | 0,099 | 0,086 | 0,085 | 0,107 | 0,085 |
| 1-1 | 030001 | A | 1 | 2 | 6 | 0,081 | 0,487 | 0,538 | 0,438 | 0,363 | 0,189 | 0,103 | 0,1 | 0,095 | 0,087 | 0,107 | 0,083 |
| 1-1 | 030001 | A | 1 | 2 | 7 | 0,082 | 0,494 | 0,516 | 0,405 | 0,351 | 0,196 | 0,115 | 0,094 | 0,091 | 0,085 | 0,107 | 0,084 |
| 1-1 | 030001 | A | 1 | 2 | 8 | 0,079 | 0,506 | 0,51 | 0,379 | 0,326 | 0,187 | 0,12 | 0,098 | 0,097 | 0,086 | 0,099 | 0,084 |
| Moyenne | 0,081 | 0,497 | 0,510 | 0,403 | 0,323 | 0,202 | 0,118 | 0,103 | 0,096 | 0,088 | 0,105 | 0,084 | |||||
| É.-T | 0,001 | 0,010 | 0,020 | 0,018 | 0,022 | 0,017 | 0,011 | 0,008 | 0,006 | 0,004 | 0,003 | 0,001 | |||||
| Coeff. Var. | 1,3 | 2,1 | 3,9 | 4,5 | 6,9 | 8,2 | 9,3 | 8,0 | 5,9 | 4,1 | 3,3 | 0,8 | |||||
Note: The following codes are used to indicate the applied fraction of mainstream smoke:
A - Particulate (DMSO), B - Gas/Vapour (PBS), C - A + B (DMSO + PBS)
4 Données d’absorbance corrigées pour les blancs
Le tableau suivant présente les valeurs d’absorbance corrigées en fonction du blanc issues des résultats du test de fixation du rouge neutre. Il indique les valeurs d’absorbance brutes obtenues sur plaque pour chaque échantillon. Les propriétés des échantillons figurant dans le tableau sont les suivantes : code d’échantillon, fraction de la fumée, numéro de sous-échantillon, numéro de plaque et numéro de puits. Les résultats du blanc d’essai et du témoin sont aussi présentés, de même que les valeurs d’absorbance associées à plusieurs concentrations de condensat de fumée de cigarette (allant de 10 à 200 ug/mL) et de laurylsulfate de sodium (allant de 110 à 200 ug/mL).
| Groupe/essai | Échant. | Fraction de fumée | Répét. | Plaque | Puits | Lectures d’absorbance corrigées en fonction du blanc | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Témoin* | Matière particulaire totale (µg/mL) | SLS (µg/mL) | ||||||||||||||
| 10 | 50 | 75 | 100 | 120 | 140 | 160 | 200 | 110 | 200 | |||||||
| 1-1 | 030001 | A | 1 | 1 | 1 | 0,396 | 0,412 | 0,341 | 0,233 | 0,121 | 0,053 | 0,035 | 0,018 | 0,007 | 0,056 | 0,002 |
| 1-1 | 030001 | A | 1 | 1 | 2 | 0,422 | 0,440 | 0,319 | 0,270 | 0,124 | 0,064 | 0,040 | 0,022 | 0,010 | 0,033 | 0,003 |
| 1-1 | 030001 | A | 1 | 1 | 3 | 0,425 | 0,405 | 0,318 | 0,237 | 0,147 | 0,033 | 0,030 | 0,013 | 0,003 | 0,026 | 0,000 |
| 1-1 | 030001 | A | 1 | 1 | 4 | 0,388 | 0,390 | 0,335 | 0,157 | 0,128 | 0,031 | 0,021 | 0,013 | 0,003 | 0,021 | 0,001 |
| 1-1 | 030001 | A | 1 | 1 | 5 | 0,424 | 0,455 | 0,321 | 0,265 | 0,135 | 0,036 | 0,024 | 0,011 | 0,005 | 0,042 | 0,002 |
| 1-1 | 030001 | A | 1 | 1 | 6 | 0,416 | 0,397 | 0,313 | 0,197 | 0,110 | 0,032 | 0,017 | 0,011 | 0,006 | 0,033 | 0,020 |
| 1-1 | 030001 | A | 1 | 1 | 7 | 0,422 | 0,431 | 0,320 | 0,239 | 0,116 | 0,033 | 0,019 | 0,007 | 0,002 | 0,035 | 0,007 |
| 1-1 | 030001 | A | 1 | 1 | 8 | 0,394 | 0,391 | 0,304 | 0,194 | 0,100 | 0,035 | 0,015 | 0,014 | 0,001 | 0,046 | 0,003 |
| Moyenne | 0,411 | 0,415 | 0,322 | 0,224 | 0,123 | 0,040 | 0,025 | 0,014 | 0,005 | 0,037 | 0,005 | |||||
| É.-T | 0,015 | 0,024 | 0,012 | 0,039 | 0,015 | 0,012 | 0,009 | 0,005 | 0,003 | 0,011 | 0,006 | |||||
| Coeff. Var. | 3,8 | 5,8 | 3,6 | 17,2 | 11,9 | 30,4 | 35,5 | 33,1 | 61,0 | 30,5 | 129,9 | |||||
| 1-1 | 030001 | A | 1 | 2 | 1 | 0,401 | 0,389 | 0,308 | 0,233 | 0,146 | 0,049 | 0,036 | 0,021 | 0,008 | 0,022 | 0,004 |
| 1-1 | 030001 | A | 1 | 2 | 2 | 0,417 | 0,425 | 0,313 | 0,222 | 0,146 | 0,049 | 0,032 | 0,023 | 0,015 | 0,022 | 0,004 |
| 1-1 | 030001 | A | 1 | 2 | 3 | 0,413 | 0,446 | 0,329 | 0,229 | 0,110 | 0,042 | 0,025 | 0,015 | 0,007 | 0,029 | 0,003 |
| 1-1 | 030001 | A | 1 | 2 | 4 | 0,432 | 0,431 | 0,334 | 0,230 | 0,124 | 0,037 | 0,016 | 0,015 | 0,006 | 0,026 | 0,003 |
| 1-1 | 030001 | A | 1 | 2 | 5 | 0,424 | 0,422 | 0,315 | 0,225 | 0,111 | 0,020 | 0,018 | 0,005 | 0,004 | 0,026 | 0,004 |
| 1-1 | 030001 | A | 1 | 2 | 6 | 0,406 | 0,457 | 0,357 | 0,282 | 0,108 | 0,022 | 0,019 | 0,014 | 0,006 | 0,026 | 0,002 |
| 1-1 | 030001 | A | 1 | 2 | 7 | 0,413 | 0,435 | 0,324 | 0,270 | 0,115 | 0,034 | 0,013 | 0,010 | 0,004 | 0,026 | 0,003 |
| 1-1 | 030001 | A | 1 | 2 | 8 | 0,425 | 0,429 | 0,298 | 0,245 | 0,106 | 0,039 | 0,017 | 0,016 | 0,005 | 0,018 | 0,003 |
| Moyenne | 0,417 | 0,430 | 0,323 | 0,242 | 0,121 | 0,037 | 0,022 | 0,015 | 0,007 | 0,025 | 0,004 | |||||
| É.-T | 0,010 | 0,020 | 0,018 | 0,022 | 0,017 | 0,011 | 0,008 | 0,006 | 0,004 | 0,003 | 0,001 | |||||
| Coeff. Var. | 2,5 | 4,6 | 5,6 | 9,2 | 13,6 | 29,8 | 36,9 | 37,6 | 50,0 | 14,1 | 20,2 | |||||
Nota : Les codes suivants sont utilisés pour indiquer la fraction de la fumée principale utilisée
A - Particules (DMSO), B - Phase gazeuse (PBS), C - A + B (DMSO + PBS)
5 Données d’absorbance relatives
Le tableau suivant présente les valeurs d’absorbance relative issues des résultats du test de fixation du rouge neutre. Il indique les valeurs d’absorbance brutes obtenues sur plaque pour chaque échantillon. Les propriétés des échantillons figurant dans le tableau sont les suivantes : code d’échantillon, fraction de la fumée, numéro de sous-échantillon, numéro de plaque et numéro de puits. Les résultats du blanc d’essai et du témoin sont aussi présentés, de même que les valeurs d’absorbance associées à plusieurs concentrations de condensat de fumée de cigarette (allant de 10 à 200 ug/mL) et de laurylsulfate de sodium (allant de 110 à 200 ug/mL).
| Groupe/essai | Échant. | Fraction de fumée | Sous- échantillon | Plaque | Puits | Lectures d’absorbance relatives | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Matière particulaire totale (µg/mL) | SLS (µg/mL) | ||||||||||||||
| 10 | 50 | 75 | 100 | 120 | 140 | 160 | 200 | 110 | 200 | ||||||
| 1-1 | 030001 | A | 1 | 1 | 1 | 100 | 83,0 | 56,7 | 29,5 | 13,0 | 8,57 | 4,44 | 1,76 | 13,7 | 0,547 |
| 1-1 | 030001 | A | 1 | 1 | 2 | 107 | 77,7 | 65,7 | 30,2 | 15,6 | 9,79 | 5,41 | 2,49 | 8,09 | 0,791 |
| 1-1 | 030001 | A | 1 | 1 | 3 | 98,6 | 77,4 | 57,7 | 35,8 | 8,09 | 7,36 | 3,22 | 0,791 | 6,38 | 0,061 |
| 1-1 | 030001 | A | 1 | 1 | 4 | 94,9 | 81,5 | 38,2 | 31,2 | 7,60 | 5,17 | 3,22 | 0,791 | 5,17 | 0,304 |
| 1-1 | 030001 | A | 1 | 1 | 5 | 111 | 78,1 | 64,5 | 32,9 | 8,82 | 5,90 | 2,74 | 1,28 | 10,3 | 0,547 |
| 1-1 | 030001 | A | 1 | 1 | 6 | 96,6 | 76,2 | 48,0 | 26,8 | 7,84 | 4,20 | 2,74 | 1,52 | 8,09 | 4,93 |
| 1-1 | 030001 | A | 1 | 1 | 7 | 105 | 77,9 | 58,2 | 28,3 | 8,09 | 4,68 | 1,76 | 0,547 | 8,57 | 1,76 |
| 1-1 | 030001 | A | 1 | 1 | 8 | 95,2 | 74,0 | 47,2 | 24,4 | 8,57 | 3,71 | 3,47 | 0,304 | 11,2 | 0,791 |
| Moyenne | 101 | 78,2 | 54,5 | 29,9 | 9,70 | 6,17 | 3,37 | 1,19 | 8,94 | 1,22 | |||||
| É.-T | 6 | 2,9 | 9,4 | 3,6 | 2,95 | 2,19 | 1,12 | 0,72 | 2,72 | 1,58 | |||||
| Coeff. Var. | 5,8 | 3,6 | 17,2 | 11,9 | 30,4 | 35,5 | 33,1 | 61,0 | 30,5 | 129,9 | |||||
| 1-1 | 030001 | A | 1 | 2 | 1 | 93,4 | 74,0 | 56,0 | 35,1 | 11,8 | 8,70 | 5,10 | 1,98 | 5,34 | 1,02 |
| 1-1 | 030001 | A | 1 | 2 | 2 | 102 | 75,2 | 53,3 | 35,1 | 11,8 | 7,74 | 5,58 | 3,66 | 5,34 | 1,02 |
| 1-1 | 030001 | A | 1 | 2 | 3 | 107 | 79,0 | 55,0 | 26,5 | 10,1 | 6,06 | 3,66 | 1,74 | 7,02 | 0,780 |
| 1-1 | 030001 | A | 1 | 2 | 4 | 104 | 80,2 | 55,3 | 29,8 | 8,94 | 3,90 | 3,66 | 1,50 | 6,30 | 0,780 |
| 1-1 | 030001 | A | 1 | 2 | 5 | 101 | 75,7 | 54,1 | 26,7 | 4,86 | 4,38 | 1,26 | 1,02 | 6,30 | 1,02 |
| 1-1 | 030001 | A | 1 | 2 | 6 | 110 | 85,7 | 67,7 | 26,0 | 5,34 | 4,62 | 3,42 | 1,50 | 6,30 | 0,540 |
| 1-1 | 030001 | A | 1 | 2 | 7 | 104 | 77,8 | 64,9 | 27,7 | 8,22 | 3,18 | 2,46 | 1,02 | 6,30 | 0,780 |
| 1-1 | 030001 | A | 1 | 2 | 8 | 103 | 71,6 | 58,9 | 25,5 | 9,42 | 4,14 | 3,90 | 1,26 | 4,38 | 0,780 |
| Moyenne | 103 | 77,4 | 58,1 | 29,0 | 8,82 | 5,34 | 3,63 | 1,71 | 5,91 | 0,840 | |||||
| É.-T | 5 | 4,4 | 5,3 | 4,0 | 2,63 | 1,97 | 1,37 | 0,86 | 0,83 | 0,170 | |||||
| Coeff. Var. | 4,6 | 5,6 | 9,2 | 13,6 | 29,8 | 36,9 | 37,6 | 50,0 | 14,1 | 20,2 | |||||
Nota : Les codes suivants sont utilisés pour indiquer la fraction de la fumée principale utilisée
A - Particules (DMSO), B - Phase gazeuse (PBS), C - A + B (DMSO + PBS)